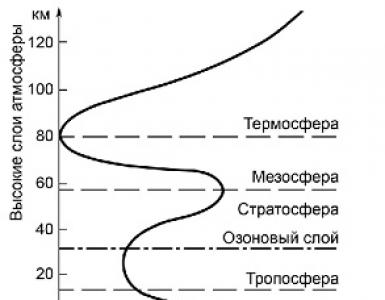
Ipertrofia muscolare che lavora. Ipertrofia Ipertrofia, definizione del concetto
Perché il La forza di un muscolo dipende dal suo diametro; il suo aumento è accompagnato da un aumento della forza di questo muscolo. L'aumento del diametro muscolare a seguito dell'allenamento fisico è chiamato ipertrofia muscolare che lavora (dal greco "trophos" - nutrizione). Le fibre muscolari, essendo cellule differenziate altamente specializzate, non sembrano essere in grado di dividersi cellulare per formare nuove fibre. In ogni caso, se avviene la divisione delle cellule muscolari, ciò avviene solo in casi particolari e in quantità molto ridotte. L'ipertrofia muscolare che lavora si verifica quasi o esclusivamente a causa dell'ispessimento (aumento di volume) delle fibre muscolari esistenti. Con un significativo ispessimento delle fibre muscolari, è possibile la loro divisione meccanica longitudinale con la formazione di fibre “figlie” con un tendine comune. Durante l'allenamento della forza, il numero di fibre divise longitudinalmente aumenta.
Potere distinguere due tipi estremi di ipertrofia lavorativa delle fibre muscolari: sarcoplasmatica e miofibrillare. L'ipertrofia lavorativa sarcoplasmatica è l'ispessimento delle fibre muscolari dovuto ad un aumento predominante del volume del sarcoplasma, cioè della loro parte non contrattile. L'ipertrofia di questo tipo si verifica a causa di un aumento del contenuto di proteine non contrattili (in particolare mitocondriali) e delle riserve metaboliche delle fibre muscolari: glicogeno, sostanze prive di azoto, creatina fosfato, mioglobina, ecc. Un aumento significativo del numero dei capillari a seguito dell'allenamento può anche causare un certo ispessimento del muscolo.
Maggior parte Apparentemente, le fibre ossidative lente (I) e veloci (II-A) sono predisposte all'ipertrofia sarcoplasmatica. L'ipertrofia lavorativa di questo tipo ha scarso effetto sulla crescita della forza muscolare, ma aumenta significativamente la capacità di lavorare per lunghi periodi di tempo, cioè aumenta la loro resistenza.
Miofibrillare l'ipertrofia lavorativa è associata ad un aumento del numero e del volume delle miofibrille, cioè dell'apparato contrattile vero e proprio delle fibre muscolari. Allo stesso tempo, aumenta la densità delle miofibrille nella fibra muscolare. Questa ipertrofia funzionale delle fibre muscolari porta ad un aumento significativo del muscolo MS. Anche la forza assoluta del muscolo aumenta in modo significativo e con l'ipertrofia lavorativa del primo tipo non cambia affatto o addirittura diminuisce leggermente. Sembra che le fibre muscolari a contrazione rapida (II-B) siano più suscettibili all’ipertrofia miofibrillare.
IN In situazioni reali, l'ipertrofia delle fibre muscolari è una combinazione dei due tipi nominati con la predominanza di uno di essi. Lo sviluppo predominante dell'uno o dell'altro tipo di ipertrofia lavorativa è determinato dalla natura dell'allenamento muscolare. Gli esercizi dinamici a lungo termine che sviluppano la resistenza, con un carico di forza relativamente piccolo sui muscoli, causano principalmente l'ipertrofia lavorativa del primo tipo. Gli esercizi con grandi tensioni muscolari (oltre il 70% della MVC dei gruppi muscolari allenati), al contrario, contribuiscono allo sviluppo dell'ipertrofia lavorativa, principalmente del secondo tipo.
IN La base dell'ipertrofia lavorativa è la sintesi intensiva e la ridotta degradazione delle proteine muscolari. Di conseguenza, la concentrazione di DNA e RNA nel muscolo ipertrofico è maggiore che nel muscolo normale. La creatina, il cui contenuto aumenta durante la contrazione muscolare, può stimolare una maggiore sintesi di actina e miosina e quindi contribuire allo sviluppo dell'ipertrofia lavorativa delle fibre muscolari.
Molto Gli androgeni (ormoni sessuali maschili) svolgono un ruolo importante nella regolazione del volume della massa muscolare, in particolare nello sviluppo dell'ipertrofia muscolare. Negli uomini sono prodotti dalle gonadi (testicoli) e nella corteccia surrenale, e nelle donne - solo nella corteccia surrenale. Di conseguenza, gli uomini hanno più androgeni nei loro corpi rispetto alle donne. Il ruolo degli androgeni nell'aumento della massa muscolare è il seguente.
Età lo sviluppo della massa muscolare avviene parallelamente ad un aumento della produzione di ormoni androgeni. Il primo evidente ispessimento delle fibre muscolari si osserva all'età di 6-7 anni, quando aumenta la formazione di androgeni. Con l'inizio della pubertà (all'età di 11-15 anni), nei ragazzi inizia un intenso aumento della massa muscolare, che continua dopo la pubertà. Nelle ragazze, lo sviluppo della massa muscolare termina generalmente con la pubertà. Anche la crescita della forza muscolare in età scolare ha un carattere corrispondente.
Anche Dopo aver aggiustato gli indicatori di forza in base alle dimensioni corporee, gli indicatori di forza nelle donne adulte sono inferiori rispetto agli uomini. Allo stesso tempo, se nelle donne, a causa di alcune malattie, aumenta la secrezione di androgeni da parte delle ghiandole surrenali, la massa muscolare aumenta intensamente, appare un sollievo muscolare ben sviluppato e la forza muscolare aumenta.
IN Esperimenti su animali hanno dimostrato che la somministrazione di ormoni androgeni (steroidi anabolizzanti) provoca una significativa intensificazione della sintesi proteica muscolare, con conseguente aumento della massa dei muscoli allenati e, di conseguenza, della loro forza. Allo stesso tempo, lo sviluppo dell'ipertrofia lavorativa dei muscoli scheletrici può avvenire senza la partecipazione di ormoni androgeni e di altro tipo (ormone della crescita, insulina e ormoni tiroidei).
Energia l'allenamento, come altri tipi di allenamento, non sembra modificare il rapporto nei muscoli dei due principali tipi di fibre muscolari: veloce e lenta. Allo stesso tempo, è in grado di modificare il rapporto tra due tipi di fibre veloci, aumentando la percentuale di fibre veloci glicolitiche (FG) e, di conseguenza, riducendo la percentuale di fibre veloci ossidativo-glicolitiche (FOG) (Tabella 7). Inoltre, come risultato dell’allenamento di forza, il grado di ipertrofia delle fibre muscolari veloci è molto maggiore di quello delle fibre ossidative lente (SO), mentre l’allenamento di resistenza porta all’ipertrofia principalmente delle fibre lente. Queste differenze mostrano che il grado di ipertrofia lavorativa di una fibra muscolare dipende sia dall'entità del suo utilizzo durante l'allenamento, sia dalla sua capacità di ipertrofia.
Energia l'allenamento prevede un numero relativamente piccolo di contrazioni muscolari ripetute massimali o quasi massimali, che coinvolgono sia le fibre muscolari veloci che quelle lente. Tuttavia, un piccolo numero di ripetizioni è sufficiente per sviluppare l'ipertrofia lavorativa delle fibre veloci, il che indica la loro maggiore predisposizione allo sviluppo dell'ipertrofia lavorativa (rispetto alle fibre lente). Un'elevata percentuale di fibre a contrazione rapida nei muscoli è un prerequisito importante per un aumento significativo della forza muscolare con un allenamento di forza mirato. Pertanto, le persone con un’alta percentuale di fibre a contrazione rapida nei muscoli hanno un potenziale maggiore per sviluppare forza e potenza.
Formazione la resistenza è associata a un gran numero di contrazioni muscolari ripetute di forza relativamente bassa, che sono fornite principalmente dall'attività delle fibre muscolari lente. Pertanto è comprensibile che l'ipertrofia di lavoro delle fibre muscolari lente sia più pronunciata con questo tipo di allenamento rispetto all'ipertrofia delle fibre veloci, soprattutto quelle glicolitiche veloci (vedi Tabella 7).
Tabella 7.
Composizione del muscolo quadricipite femorale (testa esterna) e area della sezione trasversale di diversi tipi di fibre muscolari in atleti di diverse specializzazioni e non atleti (F. Prince, et al., 1976)
Pagina 1
Poiché la forza di un muscolo dipende dal suo diametro, il suo aumento è accompagnato da un aumento della forza di questo muscolo. L'aumento del diametro muscolare a seguito dell'allenamento fisico è chiamato ipertrofia muscolare che lavora (dal greco "trophos" - nutrizione). Le fibre muscolari, essendo cellule differenziate altamente specializzate, non sembrano essere in grado di dividersi cellulare per formare nuove fibre. In ogni caso, se avviene la divisione delle cellule muscolari, ciò accade solo in casi particolari e in quantità molto ridotte. L'ipertrofia muscolare che lavora si verifica quasi o esclusivamente a causa dell'ispessimento (aumento di volume) delle fibre muscolari esistenti. Con un significativo ispessimento delle fibre muscolari, è possibile la loro divisione meccanica longitudinale con la formazione di fibre “figlie” con un tendine comune. Durante l'allenamento della forza, il numero di fibre divise longitudinalmente aumenta.
Si possono distinguere due tipi estremi di ipertrofia lavorativa delle fibre muscolari: sarcoplasmatica e miofibrillare. L'ipertrofia lavorativa sarcoplasmatica è un ispessimento delle fibre muscolari dovuto ad un aumento predominante del volume del sarcoplasma, cioè della loro parte non contrattile. L'ipertrofia di questo tipo si verifica a causa di un aumento del contenuto di proteine non contrattili (in particolare mitocondriali) e delle riserve metaboliche delle fibre muscolari: glicogeno, senza sostanze azotate, creatina fosfato, mioglobina, ecc. Un aumento significativo del numero di i capillari a seguito dell'allenamento possono anche causare un certo ispessimento del muscolo.
Le fibre ossidative lente e veloci sembrano essere le più predisposte all’ipertrofia sarcoplasmatica. L'ipertrofia lavorativa di questo tipo ha scarso effetto sulla crescita della forza muscolare, ma aumenta significativamente la capacità di lavorare per lunghi periodi di tempo, cioè aumenta la loro resistenza.
L'ipertrofia lavorativa miofibrillare è associata ad un aumento del numero e del volume delle miofibrille, cioè dell'apparato contrattile vero e proprio delle fibre muscolari. Allo stesso tempo, aumenta la densità delle miofibrille nella fibra muscolare. Questa ipertrofia funzionale delle fibre muscolari porta ad un aumento significativo del muscolo MS. Anche la forza assoluta del muscolo aumenta in modo significativo e con l'ipertrofia lavorativa del primo tipo non cambia affatto o addirittura diminuisce leggermente. Apparentemente, le fibre muscolari veloci sono più inclini all'ipertrofia miofibrillare.
In situazioni reali, l'ipertrofia delle fibre muscolari è una combinazione dei due tipi nominati, con la predominanza di uno dei due. Lo sviluppo predominante dell'uno o dell'altro tipo di ipertrofia lavorativa è determinato dalla natura dell'allenamento muscolare. Gli esercizi dinamici a lungo termine che sviluppano la resistenza, con un carico di forza relativamente piccolo sui muscoli, causano principalmente l'ipertrofia lavorativa del primo tipo. Gli esercizi con grandi tensioni muscolari (oltre il 70% della MVC dei gruppi muscolari allenati), al contrario, contribuiscono allo sviluppo dell'ipertrofia lavorativa, principalmente del secondo tipo.
La base dell'ipertrofia lavorativa è la sintesi intensiva e la ridotta degradazione delle proteine muscolari. Di conseguenza, la concentrazione di DNA e RNA nel muscolo ipertrofico è maggiore che nel muscolo normale. La creatina, il cui contenuto aumenta durante la contrazione muscolare, può stimolare una maggiore sintesi di actina e miosina e quindi contribuire allo sviluppo dell'ipertrofia lavorativa delle fibre muscolari.
Gli androgeni (ormoni sessuali maschili) svolgono un ruolo molto importante nella regolazione del volume della massa muscolare, in particolare nello sviluppo dell'ipertrofia muscolare. Negli uomini sono prodotti dalle gonadi (testicoli) e nella corteccia surrenale, e nelle donne - solo nella corteccia surrenale. Di conseguenza, gli uomini hanno più androgeni nei loro corpi rispetto alle donne. Il ruolo degli androgeni nell'aumento della massa muscolare è il seguente.
Guarda anche
Virus dell'immunodeficienza
Nel 1982, gli scienziati furono in grado di scoprire che la causa dell'AIDS è un virus che attacca le cellule del sistema immunitario umano, rendendole incapaci di proteggere il corpo dalle malattie. È già martedì...
Disturbi dell'emostasi di origine vascolare
Ereditari: 1. Gli emangiomi sono tumori vascolari, tra i quali esistono forme che talvolta causano sanguinamento locale dovuto all'assottigliamento o all'infiammazione della parete vascolare. Localizzazione - pelle...
Anemia emolitica
Cause: cambiamenti nelle membrane dei globuli rossi; difetto dei sistemi enzimatici (glucosio-6-fosfato deidrogenasi); aumento della sensibilità dei globuli rossi a determinati fattori del sangue (complemento). IN...
45. Ipertrofia, definizione del concetto.
Ipertrofia(dal greco iper - eccessivamente, trofeo - nutrizione) - aumento di un organo o tessuto dovuto ai suoi elementi parenchimali.
Si realizza sia a causa dell'iperplasia cellulare che dell'aumento delle dimensioni delle singole cellule. Ciò si verifica nei casi in cui il carico funzionale è elevato e prolungato, l'iperplasia delle ultrastrutture cellulari raggiunge livelli elevati, la massa di queste ultime aumenta e, osservando ciò al microscopio ottico, si parla di ipertrofia cellulare. Negli organi le cui cellule non si moltiplicano (miocardio, sistema nervoso centrale), questo processo si esprime esclusivamente nell'iperplasia delle ultrastrutture e, di conseguenza, nell'ipertrofia cellulare. Laddove le cellule sono in grado di moltiplicarsi, l'organo si ingrandisce a causa sia dell'ipertrofia che dell'iperplasia cellulare. Pertanto, l'ipertrofia, in linea di principio, è l'espressione “esterna” di un alto grado di iperplasia.
Clinicamente e morfologicamente si distinguono i seguenti tipi di ipertrofia:
1. Lavoro o compensazione, che avviene sotto l'influenza di un aumento del carico posto su un organo o tessuto.
2. Ipertrofia vicaria o sostitutiva, che si sviluppa in organi pari quando uno di essi viene rimosso o quando viene rimossa una parte di un organo, ad esempio nel fegato e nei polmoni.
3. Ipertrofia ormonale (neuroumorale) o correlativa. Un esempio di tale ipertrofia in condizioni fisiologiche è l'ingrossamento dell'utero durante la gravidanza. In condizioni patologiche, tale ipertrofia si verifica quando la funzione delle ghiandole endocrine è compromessa. Un esempio è l'acromegalia, che si verifica con i tumori della ghiandola pituitaria anteriore e l'iperplasia ghiandolare dell'endometrio con disfunzione ovarica.
4. Crescite ipertrofiche, che più spesso si verificano con infiammazione sotto forma di polipi iperplastici, condilomi o con ridotta circolazione linfatica e ristagno della linfa negli arti inferiori, che porta allo sviluppo di elefantiasi dovuta alla proliferazione del tessuto connettivo.
5. Inoltre, si distingue l'ipertrofia patologica quando un organo si allarga in assenza di uno stimolo appropriato. Esempi di tale ipertrofia sono le varianti ipertrofiche della cirrosi epatica, le forme dilatative e costrittive della cardiomiopatia.
In patologia esiste il concetto di falsa ipertrofia, quando un organo aumenta di dimensioni a causa di elementi non parenchimali. Un esempio di tale falsa ipertrofia è la semplice obesità del cuore, quando le dimensioni di questo organo aumentano a causa della crescita del tessuto adiposo.
Il processo opposto all'ipertrofia è l'atrofia.
46. Ipertrofia lavorativa, cause; esempi.
Lavoro o compensazione, che avviene sotto l'influenza di un aumento del carico posto su un organo o tessuto. In condizioni fisiologiche, un esempio di ipertrofia lavorativa è un aumento della massa dei muscoli striati negli atleti e nelle persone che svolgono lavori fisici pesanti. In condizioni di malattia o processo patologico, un organo o parte di esso deve funzionare intensamente. Questo tipo di ipertrofia si verifica solitamente negli organi cavi: tratto gastrointestinale, vescica. Nella pratica clinica, l'ipertrofia cardiaca funzionante è di grande importanza. Morfologicamente si distinguono due tipi di ipertrofia di questo organo: concentrico - quando l'ispessimento del miocardio avviene senza espansione delle cavità del cuore ed eccentrico - accompagnato da una significativa espansione delle cavità del cuore. L'ipertrofia concentrica si sviluppa, di regola, con ipertensione arteriosa e ipertensione arteriosa sintomatica e di solito colpisce la parete del ventricolo sinistro. Lo spessore della sua parete può raggiungere 3 o più centimetri (la norma è 1,2 cm). L'ipertrofia eccentrica si verifica con difetti cardiaci quando il sangue residuo si accumula nelle sue cavità. In questo caso, le dimensioni del cuore possono raggiungere grandi dimensioni, come accade con i difetti aortici.
Microscopicamente, i cardiomiociti aumentano di volume e si addensano in modo non uniforme. I loro nuclei diventano grandi e ipercromatici. Allo stesso tempo, aumenta il numero di capillari e fibre argirofile nello stroma miocardico e aumenta il numero e la dimensione delle ultrastrutture di ciascuna cellula.
Se la causa viene eliminata, l'esito dell'ipertrofia lavorativa è favorevole. Altrimenti, si verifica lo scompenso dell'organo ipertrofico con lo sviluppo di processi distrofici, necrotici e sclerotici in esso.
L'ipertrofia di varie parti del cuore è una patologia abbastanza comune che si verifica a causa di danni non solo al muscolo cardiaco o alle valvole, ma anche quando il flusso sanguigno nel circolo polmonare viene interrotto a causa di malattie polmonari, varie anomalie congenite nella struttura del cuore, a causa dell’aumento della pressione sanguigna, così come nelle persone sane che svolgono un’attività fisica significativa.
Cause dell'ipertrofia ventricolare sinistra
Tra cause dell'ipertrofia LV si possono distinguere:
- Ipertensione arteriosa;
- Stenosi (restringimento) della valvola aortica;
- Cardiomiopatia ipertrofica;
- Aumento dell'attività fisica.
- Quindi, con l'ipertrofia del cuore destro, l'ECG mostrerà un cambiamento nella conduttività elettrica, la comparsa di disturbi del ritmo, un aumento dell'onda R nelle derivazioni V 1 e V 2, nonché una deviazione dell'asse elettrico del cuore a destra.
- Con l'ipertrofia ventricolare sinistra, l'ECG mostrerà segni di deviazione dell'asse elettrico del cuore a sinistra o della sua posizione orizzontale, un'onda R alta nelle derivazioni V 5 e V 6 e altri. Inoltre vengono registrati anche i segni di tensione (cambiamenti nell'ampiezza delle onde R o S).
Dai risultati si possono giudicare anche i cambiamenti nella configurazione del cuore dovuti all'ingrossamento di alcune parti del cuore radiografia organi del torace.
Schemi: ipertrofia ventricolare e atriale sull'ECG

Ipertrofia del ventricolo sinistro (a sinistra) e del ventricolo destro del cuore (a destra)

Ipertrofia degli atri sinistro (sinistro) e destro (destro).
Trattamento dell'ipertrofia cardiaca
Il trattamento dell'ipertrofia di varie parti del cuore si riduce a influenzare la causa che l'ha causata.

In caso di sviluppo del cuore polmonare a causa di malattie dell'apparato respiratorio, si cerca di compensare la funzione polmonare prescrivendo terapia antinfiammatoria, broncodilatatori e altri, a seconda della causa sottostante.
Il trattamento dell'ipertrofia ventricolare sinistra nell'ipertensione arteriosa è ridotto all'uso di farmaci antipertensivi di vari gruppi.
In presenza di gravi difetti valvolari è possibile il trattamento chirurgico fino alla protesica.
In tutti i casi, combattono i sintomi del danno miocardico: secondo le indicazioni, viene prescritta la terapia antiaritmica, farmaci che migliorano i processi metabolici nel muscolo cardiaco (ATP, riboxina, ecc.). Si consiglia di seguire una dieta con apporto limitato di sale e liquidi, normalizzazione del peso corporeo in caso di obesità.
Per i difetti cardiaci congeniti, se possibile, i difetti vengono eliminati chirurgicamente. In caso di gravi disturbi nella struttura del cuore, lo sviluppo della cardiomiopatia ipertrofica, potrebbe essere l'unica via d'uscita dalla situazione.
In generale, l'approccio al trattamento di tali pazienti è sempre individuale, tenendo conto di tutte le manifestazioni esistenti di disfunzione cardiaca, condizioni generali e presenza di malattie concomitanti.
In conclusione, vorrei sottolinearlo L'ipertrofia miocardica acquisita rilevata nel tempo è abbastanza suscettibile di correzione. Se sospetti eventuali disturbi nel funzionamento del cuore, dovresti consultare immediatamente un medico, identificherà la causa della malattia e prescriverà un trattamento che ti darà una possibilità per molti anni di vita.
Video: ipertrofia ventricolare sinistra nel programma "Informazioni sulla cosa più importante"
Ipertrofia (dal greco iper - eccessivamente, trofeo - nutrizione) - aumento delle dimensioni di un organo o tessuto dovuto all'aumento delle dimensioni di ciascuna cellula.
Secondo la patogenesi, si distinguono le seguenti forme di ipertrofia:
Lavorativo o compensativo;
Vicario o sostituto;
Ormonale o neuroumorale.
Il tipo più comune di ipertrofia è l'ipertrofia lavorativa, che si verifica sia in condizioni fisiologiche che in alcune condizioni patologiche. La ragione di ciò è l'aumento del carico posto sull'organo o sul tessuto. Un esempio di ipertrofia lavorativa in condizioni fisiologiche è l'ipertrofia dei muscoli scheletrici e del cuore negli atleti che svolgono lavori fisici pesanti.
In condizioni patologiche, l'ipertrofia lavorativa si sviluppa nei casi in cui, a seguito di un processo patologico, un organo o parte di un organo deve lavorare sodo. In altre parole, l’ipertrofia lavorativa è l’ipertrofia di un organo altamente funzionante.
L'ipertrofia lavorativa si osserva nei tessuti costituiti da cellule stabili e non in divisione, in cui l'adattamento all'aumento del carico non può essere realizzato aumentando il numero di cellule. Questo tipo di ipertrofia si verifica spesso negli organi cavi che hanno una parete di muscolatura liscia: la parete dello stomaco, dell'intestino e della vescica. È un'espressione morfologica dell'ostruzione cronica. Le cause di questa ostruzione sono molteplici, ad esempio, stenosi cicatriziale del piloro conseguente alla guarigione di un'ulcera gastrica o del bulbo duodenale, tumori intestinali a crescita esofitica (cioè che crescono nel lume), iperplasia prostatica adenomatosa, che, comprimendo la uretra, impedisce l'escrezione dell'urina dalla vescica. La compensazione per la funzione di questi organi avviene a causa di un aumento del volume della muscolatura liscia della parete sopra il sito dell'ostruzione. In clinica, la cosa più importante è l'ipertrofia del cuore.
Le cause dell'ipertrofia cardiaca possono risiedere nei processi patologici del cuore stesso e in questi casi sono designate come intracardiache. In altri casi possono essere associati a patologie della circolazione polmonare o sistemica, si parla quindi di cause extracardiache.
Le cause intracardiache includono l’insufficienza cardiaca. I difetti cardiaci sono disturbi persistenti e irreversibili della struttura anatomica del cuore, accompagnati dall'interruzione della sua funzione. I difetti cardiaci sono:
Congenito;
Acquisita.
I difetti congeniti sono cambiamenti strutturali associati alla distorsione degli stadi della morfogenesi intrauterina del cuore (difetto del setto atriale o interventricolare, completa assenza del setto interventricolare o interatriale - cuore a tre camere) o alla formazione finale del sistema cardiovascolare dopo la nascita.
I difetti cardiaci acquisiti sono caratterizzati da danni all'apparato valvolare del cuore, l'aorta, e si verificano a causa di malattie cardiache dopo la nascita. La causa più comune di questi difetti sono i reumatismi, meno spesso: endocardite batterica, aterosclerosi e sifilide.
Il meccanismo di sviluppo del difetto acquisito è spesso associato alla crescita del tessuto connettivo fibroso cicatriziale nella valvola (cioè sclerosi) a causa dell'endocardite. Come risultato della deformazione sclerotica dell'apparato valvolare, possono verificarsi due tipi di difetti:
Insufficienza valvolare: i lembi valvolari non sono in grado di chiudersi ermeticamente durante la loro chiusura,
Stenosi (o restringimento) degli orifizi atrioventricolari o degli orifizi dei grandi vasi (aorta e tronco dell'arteria polmonare).
Con una combinazione di insufficienza valvolare e stenosi dell'orifizio, parlano di un difetto cardiaco combinato. Un difetto isolato è una lesione di una valvola; una lesione di due o più valvole è detta difetto combinato.
Tutte le cause extracardiache, sia nella circolazione polmonare che sistemica, sono accomunate da un sintomo clinico: l'ipertensione, cioè un aumento della pressione intravascolare, alla quale il cuore è costretto a lavorare di più.
Esistono due meccanismi principali per lo sviluppo dell'ipertrofia cardiaca: questi sono:
Aumento della pressione intraventricolare (ipertensione nella circolazione polmonare e sistemica, stenosi delle aperture valvolari),
Aumento del riempimento sanguigno dei ventricoli (insufficienza valvolare con rigurgito sanguigno).
Entrambi questi meccanismi sono accompagnati da un aumento riflesso della forza delle contrazioni cardiache. L'afflusso di sangue arterioso aumenta di riflesso verso un organo che lavora intensamente, il che porta ad un aumento del livello dei processi metabolici. E se questi fattori agiscono a lungo, vengono creati tutti i prerequisiti per lo sviluppo dell'ipertrofia lavorativa del cuore.
Cause intracardiache dell’ipertrofia ventricolare sinistra:
Stenosi aortica;
Insufficienza della valvola aortica;
Insufficienza della valvola mitrale (bicuspide).
Cause extracardiache di ipertrofia del ventricolo sinistro del cuore:
Queste sono malattie accompagnate da un aumento della pressione sanguigna nella circolazione sistemica:
Malattia ipertonica;
Ipertensione sintomatica (per malattie dei reni, delle ghiandole endocrine - tireotossicosi, tumori delle ghiandole surrenali, dell'ipofisi, ecc.);
Obesità generale (dovuta ad un aumento del volume del sistema microvascolare).
Cause intracardiache dell’ipertrofia ventricolare destra:
Stenosi dell'orifizio dell'arteria polmonare;
Insufficienza della valvola polmonare;
Insufficienza della valvola tricuspide;
Stenosi dell'orifizio atrioventricolare sinistro (mitrale);
Insufficienza della valvola mitrale (nella fase di scompenso ventricolare sinistro).
Cause extracardiache dell’ipertrofia ventricolare destra:
Si tratta di malattie polmonari accompagnate da una diminuzione del volume della circolazione polmonare e da un aumento della pressione sanguigna nel sistema dell'arteria polmonare:
Enfisema polmonare diffuso cronico;
Pneumosclerosi di varie eziologie: polmonite cronica non specifica, alveolite fibrosante, forme croniche di tubercolosi polmonare, pneumoconiosi (malattie polmonari da polvere);
Bronchite cronica che fa dell'ostruzionismo;
Ipertensione primaria lieve.
Quadro macroscopico dell'ipertrofia cardiaca:
il cuore si ingrandisce di volume, la sua massa aumenta. Se normalmente il peso del cuore è in media di 250,0-280,0 grammi, in condizioni patologiche può raggiungere il chilogrammo, e in rari casi anche di più. La parete muscolare del cuore ipertrofico è fortemente ispessita. Lo spessore normale della parete del ventricolo sinistro è 0,81,0 cm, con ipertrofia - fino a 2-3 cm. Il ventricolo destro ha normalmente uno spessore di 0,2-0,4 cm, con ipertrofia si ispessisce fino a 1,0-1,5 cm. Il setto interventricolare , muscoli papillari e trabecolari. Le cavità del cuore, di regola, sono dilatate, cioè l'ipertrofia si sviluppa in modo eccentrico.
Microscopicamente, i cardiomiociti aumentano di volume, si ispessiscono, i loro nuclei diventano grandi e ipercromatici. Allo stesso tempo, nello stroma aumenta il numero dei capillari e delle fibre argirofile. A livello ultrastrutturale si riscontra un aumento del volume e del numero degli organelli citoplasmatici nelle cellule (mitocondri, miofibrille), nell'apparato sintetico (che comprende il reticolo endoplasmatico, i ribosomi e l'apparato di Golgi).
Il risultato dell'ipertrofia lavorativa. In linea di principio, l'ipertrofia lavorativa è un processo reversibile a condizione che la causa venga eliminata in tempo. Ad esempio, se un paziente viene sottoposto tempestivamente a un intervento di chirurgia ricostruttiva per un difetto cardiaco congenito o acquisito, i cambiamenti nel cuore potrebbero invertirsi e tornare alla normalità. Ma in pratica questa opportunità è rara. Spesso il risultato è lo scompenso del cuore ipertrofico dovuto al fatto che il processo di ipertrofia è limitato dalla capacità di afflusso di sangue all'organo. Nel corso del tempo, con l'aumento della massa dell'organo, si verifica una relativa mancanza di afflusso di sangue, cioè si verifica un'ischemia cronica. I processi metabolici nel cuore ipertrofico vengono interrotti, si verificano cambiamenti distrofici e quindi cambiamenti irreversibili: morte cellulare con crescita del tessuto connettivo al loro posto, cioè si sviluppa scompenso.
Senso. L'ipertrofia che si sviluppa in un organo ha senza dubbio un significato positivo, poiché permette di mantenere la funzione dell'organo nonostante la malattia. Questo periodo è clinicamente chiamato fase di compensazione. Successivamente, quando si verificano cambiamenti distrofici nell'organo, la funzione si indebolisce e, infine, quando i meccanismi adattativi si esauriscono, si verifica lo scompenso dell'organo. E in relazione al cuore si sviluppa l'insufficienza cardiaca, che è la causa della morte del paziente.
L'ipertrofia vicaria o sostitutiva si sviluppa in organi pari (reni) o quando viene rimossa una parte di un organo, ad esempio nel fegato, nei polmoni.
Ipertrofia ormonale o correlativa. Un esempio di ipertrofia ormonale fisiologica è l'ipertrofia uterina durante la gravidanza. In condizioni patologiche, l'ipertrofia ormonale si verifica a causa della disfunzione delle ghiandole endocrine. Un esempio di tale ipertrofia è l'acromegalia (dal greco akros - estremo, sporgente, megalos - grande), causata dall'iperfunzione della ghiandola pituitaria anteriore con produzione eccessiva dell'ormone somatotropo, che di solito deriva da un adenoma eosinofilo. Con l'acromegalia si verifica un ingrossamento degli organi e delle parti sporgenti dello scheletro. Una volta rimosso il tumore, il processo è reversibile.
Si distingue anche l'ipertrofia patologica. L'ipertrofia patologica si verifica in assenza di uno stimolo appropriato - aumento del bisogno funzionale. L'ipertrofia miocardica che si verifica senza una ragione apparente (in assenza di ipertensione, malattia valvolare o cardiopatia congenita) è considerata un esempio di ipertrofia patologica ed è chiamata cardiomiopatia ipertrofica.