Ipercorticismo e ipocorticismo iatrogeno. Ipercortisolismo: che cos'è, varietà e trattamento di una malattia pericolosa
L'ipercortisolismo (sindrome di Cushing, malattia di Itsenko-Cushing) è una sindrome clinica causata da un'eccessiva secrezione di ormoni surrenali e nella maggior parte dei casi caratterizzata da ipertensione arteriosa, affaticamento e debolezza, irsutismo, strie viola sull'addome, edema, iperglicemia, osteoporosi e alcuni altri sintomi.
Eziologia e patogenesi
A seconda delle cause della malattia, ci sono:
- ipercortisolismo totale con coinvolgimento nel processo patologico di tutti gli strati della corteccia surrenale;
- ipercortisolismo parziale, accompagnato da una lesione isolata di singole zone della corteccia surrenale.
L'ipercortisolismo può essere causato da vari motivi:
- Iperplasia delle ghiandole surrenali:
- con iperproduzione primaria di ACTH (disfunzione ipofisaria-ipotalamica, microadenomi produttori di ACTH o macroadenomi ipofisari);
- con produzione ectopica primaria di tumori produttori di ACTH o CRH di tessuti non endocrini.
- Iperplasia surrenale nodulare.
- Neoplasie delle ghiandole surrenali (adenoma, carcinoma).
- Ipercorticismo iatrogeno (uso a lungo termine di glucocorticoidi o ACTH).
Indipendentemente dalla causa che provoca l'ipercortisolismo, questa condizione patologica è sempre dovuta all'aumentata produzione di cortisolo da parte delle ghiandole surrenali.
Più comune nella pratica clinica ipercortisolismo centrale(sindrome di Cushing, malattia di Itsenko-Cushing, ipercortisolismo dipendente da ACHT), che è accompagnata da iperplasia surrenale bilaterale (raramente unilaterale).
Meno comunemente, l'ipercorticismo si sviluppa a seguito della produzione autonoma indipendente dall'ACTH di ormoni steroidei da parte della corteccia surrenale con lo sviluppo di tumori in essa (corticosteroma, androsteroma, aldosteroma, corticoestroma, tumori misti) o con iperplasia macronodulare; produzione ectopica di ACTH o corticoliberina, seguita da stimolazione della funzione surrenale.
Separatamente, si distingue l'ipercorticismo iatrogeno, dovuto all'uso di glucocorticoidi o preparazioni di ormoni corticotropi nel trattamento di varie malattie, comprese quelle non endocrine.
L'ipercorticismo centrale è dovuto ad un aumento della produzione di corticoliberina e ACTH e ad una violazione della reazione dell'ipotalamo all'effetto inibitorio dei glucocorticoidi surrenali e dell'ACTH. Le ragioni dello sviluppo dell'ipercortisolismo centrale non sono state finalmente nominate, ma è consuetudine distinguere fattori esogeni ed endogeni che possono avviare un processo patologico nella zona ipotalamo-ipofisaria.
I fattori esogeni che influenzano lo stato dell'ipotalamo includono danni cerebrali traumatici, stress, neuroinfezioni e fattori endogeni: gravidanza, parto, allattamento, pubertà, menopausa.
Questi processi patologici avviano violazioni delle relazioni regolatorie nel sistema ipotalamo-ipofisario e sono realizzati da una diminuzione degli effetti dopaminergici e un aumento degli effetti serotoninergici dell'ipotalamo, che è accompagnato da un aumento della stimolazione della secrezione di ACTH da parte della ghiandola pituitaria e, di conseguenza , stimolazione della corteccia surrenale con aumento della produzione di glucocorticoidi da parte delle cellule della corteccia surrenale. In misura minore, l'ACTH stimola la zona glomerulare della corteccia surrenale con la produzione di mineralcorticoidi e la zona reticolare della corteccia surrenale con la produzione di steroidi sessuali.
L'eccessiva produzione di ormoni surrenali, secondo la legge del feedback, dovrebbe inibire la produzione di ACTH da parte della ghiandola pituitaria e di corticoliberina da parte dell'ipotalamo, ma la zona ipotalamo-ipofisaria diventa insensibile all'influenza degli steroidi periferici delle ghiandole surrenali, quindi, l'iperproduzione di glucocorticoidi, mineralcorticoidi e steroidi sessuali surrenali continua.
L'iperproduzione prolungata di ACTH da parte della ghiandola pituitaria è associata allo sviluppo di microadenomi produttori di ACTH (10 mm) della ghiandola pituitaria o iperplasia diffusa delle cellule corticotropiche (disfunzione ipotalamo-ipofisaria). Il processo patologico è accompagnato da iperplasia nodulare della corteccia surrenale e dallo sviluppo di sintomi causati da un eccesso degli ormoni elencati (glucocorticosteroidi, mineralcorticoidi e steroidi sessuali) e dai loro effetti sistemici sul corpo. Pertanto, nell'ipercortisolismo centrale, la zona ipotalamo-ipofisaria è principalmente interessata.
La patogenesi di altre forme di ipercorticismo (non di origine centrale, ipercorticismo indipendente dall'ACTH) è fondamentalmente diversa.
Ipercorticismo causato da formazioni volumetriche delle ghiandole surrenali, il più delle volte il risultato della produzione autonoma di glucocorticosteroidi (cortisolo) da parte delle cellule della zona prevalentemente fascicolare della corteccia surrenale (circa il 20-25% dei pazienti con ipercorticismo). Questi tumori di solito si sviluppano su un solo lato e circa la metà di essi sono maligni.
L'ipercortisolemia provoca l'inibizione della produzione di corticoliberina da parte dell'ipotalamo e di ACTH da parte della ghiandola pituitaria, a seguito della quale le ghiandole surrenali cessano di ricevere una stimolazione adeguata e la ghiandola surrenale invariata riduce la sua funzione e diventa ipoplasica. Rimane attivo solo il tessuto funzionante in modo autonomo, a seguito del quale si nota un aumento unilaterale della ghiandola surrenale, accompagnato dalla sua iperfunzione e dallo sviluppo di sintomi clinici appropriati.
La causa dell'ipercortisolismo parziale può essere androsteroma, aldosteroma, corticoestroma, tumori misti della corteccia surrenale. Ad oggi, le cause dell'iperplasia o delle lesioni tumorali delle ghiandole surrenali non sono state definitivamente chiarite.
La sindrome ACTH-ectopica è dovuta al fatto che i tumori con secrezione ectopica di ACTH esprimono anche il gene per la sintesi di ACTH o corticoliberina, quindi un tumore a localizzazione extrapituitaria diventa fonte di iperproduzione autonoma di peptidi simili all'ACTH o corticoliberina. La fonte della produzione ectopica di ACTH può essere tumori dei polmoni, del tubo gastrointestinale, del pancreas (cancro broncogeno, carcinoide del timo, cancro del pancreas, adenoma bronchiale, ecc.). Come risultato della produzione autonoma di ACTH o corticoliberina, le ghiandole surrenali ricevono una stimolazione eccessiva e iniziano a produrre una quantità eccessiva di ormoni, che determina la comparsa di sintomi di ipercortisolismo con lo sviluppo di segni clinici, biochimici e radiologici indistinguibili da quelli causati dall'ipersecrezione di ACTH ipofisario.
L'ipercorticismo iatrogeno può svilupparsi a seguito dell'uso a lungo termine di glucocorticoidi o ACTH nel trattamento di varie malattie e ora, a causa dell'uso frequente di questi farmaci nella pratica clinica, è la causa più comune di ipercorticismo.
A seconda delle caratteristiche individuali dei pazienti (sensibilità ai glucocorticoidi, durata, dose e regime di somministrazione del farmaco, riserve delle proprie ghiandole surrenali), l'uso di preparati glucocorticoidi porta alla soppressione della produzione di ACTH da parte della ghiandola pituitaria secondo la legge del feedback e , di conseguenza, una diminuzione della produzione endogena di ormoni della corteccia surrenale con la loro possibile ipoplasia e atrofia. L'uso a lungo termine di glucocorticoidi esogeni può essere accompagnato da sintomi di ipercorticismo di varia gravità.
Sintomi
Le manifestazioni cliniche dell'ipercorticismo sono dovute all'eccessiva influenza di glucocorticoidi, mineralcorticoidi e steroidi sessuali. Il più comune nella pratica clinica è l'ipercortisolismo centrale.
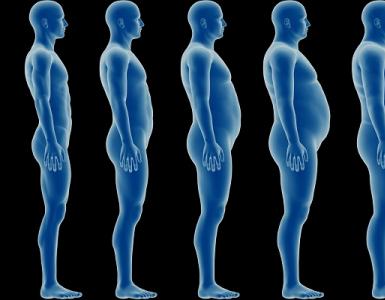
Sintomi dovuti all'eccesso di glucocorticoidi. Caratteristico è lo sviluppo dell'obesità atipica (displastica) con deposizione di grasso nel viso (faccia a forma di luna), nella regione interscapolare, nel collo, nel torace, nell'addome e la scomparsa del grasso sottocutaneo nelle estremità, dovuta a differenze nella sensibilità di tessuto adiposo di diverse parti del corpo ai glucocorticoidi. Nell'ipercortisolismo grave, il peso corporeo totale può non soddisfare i criteri per l'obesità, ma persiste la caratteristica ridistribuzione del grasso sottocutaneo.
 Vi è assottigliamento della pelle e comparsa di strie (striature) di colore viola-cianotico sul petto, nella zona delle ghiandole mammarie, sull'addome, nella zona delle spalle , l'interno coscia a causa del metabolismo alterato del collagene e delle rotture delle sue fibre e raggiungendo una larghezza di diversi centimetri. Il viso del paziente acquisisce una forma a forma di luna e ha un colore viola-cianotico in assenza di un eccesso di globuli rossi, può comparire acne (punti neri).
Vi è assottigliamento della pelle e comparsa di strie (striature) di colore viola-cianotico sul petto, nella zona delle ghiandole mammarie, sull'addome, nella zona delle spalle , l'interno coscia a causa del metabolismo alterato del collagene e delle rotture delle sue fibre e raggiungendo una larghezza di diversi centimetri. Il viso del paziente acquisisce una forma a forma di luna e ha un colore viola-cianotico in assenza di un eccesso di globuli rossi, può comparire acne (punti neri).
A causa di una violazione della biosintesi proteica e della predominanza del suo catabolismo, si sviluppa l'ipotrofia muscolare (atrofia), che si manifesta con l'obliquità dei glutei, la debolezza muscolare, l'attività motoria compromessa, nonché il rischio di ernie di varia localizzazione. C'è una scarsa guarigione della ferita a causa del metabolismo proteico alterato.
A seguito di violazioni della sintesi del collagene e della matrice proteica dell'osso, la calcificazione ossea viene disturbata, la sua densità minerale diminuisce e si sviluppa l'osteoporosi, che può essere accompagnata da fratture patologiche e compressione dei corpi vertebrali con una diminuzione della crescita ( l'osteoporosi e le fratture da compressione della colonna vertebrale sullo sfondo dell'atrofia muscolare sono spesso i sintomi principali che portano il paziente dal medico). Possibile necrosi asettica della testa del femore, meno spesso della testa dell'omero o della parte distale del femore.
La nefrolitiasi si sviluppa a causa della calciuria e sullo sfondo di una diminuzione della resistenza aspecifica - questo può causare una violazione del passaggio dell'urina e della pielonefrite.
Sono presenti segni clinici di ulcera gastrica o duodenale con rischio di sanguinamento gastrico e/o perforazione dell'ulcera. A causa dell'aumentata gluconeogenesi nel fegato e della resistenza all'insulina, la tolleranza al glucosio è compromessa e si sviluppa uno steroide secondario.
L'effetto immunosoppressivo dei glucocorticoidi si realizza mediante la soppressione dell'attività del sistema immunitario, una diminuzione della resistenza a varie infezioni e lo sviluppo o l'esacerbazione di varie localizzazioni di infezioni. L'ipertensione arteriosa si sviluppa con un aumento significativo, principalmente della pressione arteriosa diastolica, a causa della ritenzione di sodio. Ci sono cambiamenti nella psiche dall'irritabilità o dall'instabilità emotiva alla depressione grave o persino alla psicosi palese.
I bambini sono caratterizzati da una violazione (ritardo) della crescita dovuta a una violazione della sintesi del collagene e allo sviluppo della resistenza all'ormone somatotropo.
Sintomi associati a un'eccessiva secrezione di mineralcorticoidi. Causato da disturbi elettrolitici con lo sviluppo di ipokaliemia e ipernatriemia, con conseguente ipertensione arteriosa persistente e resistente ai farmaci antipertensivi e alcalosi ipokaliemica, causando miopatia e contribuendo allo sviluppo di distrofia miocardica disormonale (elettrolita-steroide) con lo sviluppo di aritmie cardiache e il comparsa di segni progressivi di insufficienza cardiaca.
Sintomi dovuti all'eccesso di steroidi sessuali. Nella maggior parte dei casi, sono più spesso rilevati nelle donne e includono la comparsa di un segno di androgenizzazione: acne, irsutismo, ipertricosi, ipertrofia del clitoride, irregolarità mestruali e disturbi della fertilità. Negli uomini, con lo sviluppo di tumori che producono estrogeni, il timbro della voce, l'intensità della crescita della barba e dei baffi cambiano, appare la ginecomastia, la potenza diminuisce e la fertilità è compromessa.
Sintomi dovuti all'eccesso di ACTH. Di solito si trova nella sindrome ACTH-ectopica e include l'iperpigmentazione della pelle e lo sviluppo minimo dell'obesità. In presenza di un macroadenoma della ghiandola pituitaria, possono comparire "sintomi chiasmali" - una violazione dei campi visivi e / o disturbi dell'acuità visiva, dell'olfatto e del flusso CSF con lo sviluppo di mal di testa persistenti che non dipendono dal livello di sangue pressione.
Diagnostica
I primi segni della malattia sono molto diversi: alterazioni della pelle, sindrome miopatica, obesità, sintomi di iperglicemia cronica (diabete mellito), disfunzione sessuale, ipertensione arteriosa.
Nel verificare l'ipercorticismo, vengono costantemente condotti studi volti a dimostrare la presenza di questa malattia con l'esclusione di condizioni patologiche simili nelle manifestazioni cliniche e la verifica della causa dell'ipercorticismo. La diagnosi di ipercortisolismo iatrogeno è confermata dall'anamnesi.
Nella fase dei sintomi clinici avanzati, la diagnosi della sindrome da ipercortisolismo non è difficile. La conferma conclusiva della diagnosi sono i dati dei metodi di ricerca di laboratorio e strumentali.
Indicatori di laboratorio:
- aumento dell'escrezione urinaria giornaliera di cortisolo libero di oltre 100 mcg/die;
- un aumento del livello di cortisolo nel sangue superiore a 23 mcg / dl o 650 nmol / l durante il monitoraggio, poiché un singolo aumento del livello di cortisolo è possibile anche con sforzo fisico, stress mentale, assunzione di estrogeni, gravidanza, obesità , anoressia nervosa, uso di droghe, assunzione di alcol;
- un aumento del livello di ACTH, aldosterone, ormoni sessuali per confermare la diagnosi di ipercortisolismo non ha valore diagnostico fondamentale.
Segnali di laboratorio indiretti:
- iperglicemia o ridotta tolleranza ai carboidrati;
- ipernatriemia e ipokaliemia;
- leucocitosi neutrofila ed eritrocitosi;
- calciuria;
- reazione alcalina dell'urina;
- un aumento del livello di urea.
test funzionali. Nei casi dubbi, vengono eseguiti test funzionali per lo screening iniziale:
- viene determinato il ritmo giornaliero di cortisolo e ACTH (con ipercorticismo, il ritmo caratteristico è disturbato dal livello massimo di cortisolo e ACTH al mattino e si nota la secrezione monotona di cortisolo e ACTH);
- piccolo test del desametasone (test di soppressione di Lidll): il desametasone viene somministrato a 4 mg/die per 2 giorni (0,5 mg ogni 6 ore per 48 ore) e sopprime la normale secrezione di ACTH e cortisolo, quindi la mancanza di soppressione della cortisolemia è un criterio per l'ipercortisolismo. Se il livello di cortisolo urinario non scende sotto i 30 mcg/die e il livello di cortisolo plasmatico non diminuisce, si pone la diagnosi di ipercortisolismo.
Visualizzazione della sella turca e delle ghiandole surrenali. Dopo aver confermato la diagnosi di ipercortisolismo, vengono condotti studi per chiarirne la causa. A tal fine, sono obbligatori studi volti a visualizzare la sella turca e le ghiandole surrenali:
- per valutare lo stato della sella turca si consiglia l'uso della risonanza magnetica o della TC, che consente di identificare o escludere la presenza di un adenoma ipofisario (si ritiene ottimale condurre uno studio con un mezzo di contrasto);
- La TC o la RM, l'angiografia selettiva o la scintigrafia surrenalica con colesterolo 19-[131 I]-iodio sono raccomandate per valutare la dimensione delle ghiandole surrenali (l'ecografia non stima in modo affidabile la dimensione delle ghiandole surrenali e pertanto non è il metodo raccomandato per imaging delle ghiandole surrenali). Il miglior metodo a raggi X per visualizzare le ghiandole surrenali è la TC, che ha soppiantato le tecniche invasive precedentemente utilizzate (come l'arteriografia selettiva e la venografia surrenale), poiché la scansione TC può non solo localizzare il tumore surrenale, ma anche distinguerlo dall'iperplasia bilaterale. Il metodo di scelta per l'imaging dei tumori surrenali è l'uso della tomografia a emissione di positroni (PET-scan) con un analogo del glucosio 18-fluoro-deossi-D-glucosio (18 FDG), che si accumula selettivamente nel tessuto tumorale, o un inibitore del enzima chiave della sintesi del cortisolo 11-β-idrossilasi 11C -metomidato;
- è possibile eseguire una biopsia della ghiandola surrenale, tuttavia, nonostante il basso rischio di complicanze e l'accuratezza piuttosto elevata, lo studio viene eseguito almeno, grazie ai moderni metodi di imaging delle ghiandole surrenali.
prova soppressiva. In assenza di adenoma ipofisario o ingrossamento unilaterale della ghiandola surrenale, viene eseguito un test soppressivo per chiarire la causa dell'ipercortisolismo:
- test desametasone grande (completo) (test Liddle grande) - vengono prescritti 8 mg di desametasone al giorno per 2 giorni e viene preso in considerazione lo stato della funzione surrenale dopo il desametasone. L'assenza di soppressione della produzione di cortisolo è un criterio per l'autonomia della secrezione ormonale, che consente di escludere l'ipercorticismo centrale, e la soppressione della secrezione di cortisolo è considerata una conferma dell'ipercorticismo centrale ACTH-dipendente;
- test meno comunemente utilizzato con metopirone (750 mg ogni 4 ore, 6 dosi). Secondo i risultati del test nella maggior parte dei pazienti con ipercortisolismo centrale, il livello di cortisolo nelle urine aumenta e l'assenza di reazione indica una neoplasia delle ghiandole surrenali o la loro iperplasia dovuta a un tumore che produce ACTH di origine non endocrina tessuto.
Ulteriori criteri diagnostici:
- restringimento dei campi visivi (emianopsia bitemporale), capezzoli congestizi dei nervi ottici;
- ECG con l'identificazione dei segni che caratterizzano la distrofia miocardica;
- densitometria ossea con rilevazione di osteoporosi o osteopenia;
- esame da parte di un ginecologo con valutazione delle condizioni dell'utero e delle ovaie;
- fibrogastroduodenoscopia per escludere un tumore ectopico che produce ACTH.
Identificazione del vero focus della produzione di ACTH. Se si escludono l'ipercorticismo iatrogeno, l'ipercorticismo centrale ACTH-dipendente e l'ipercorticismo tumore-indotto o l'iperplasia surrenale isolata, è probabile che la causa dell'ipercorticismo sia la sindrome ACTH-ectopica. Per identificare il vero focus della produzione di ACTH o corticoliberina, si raccomanda un esame volto a trovare un tumore e che includa la visualizzazione dei polmoni, della ghiandola tiroidea, del pancreas, del timo e del tratto gastrointestinale. Se è necessario rilevare un tumore ACTH-ectopico, è possibile utilizzare la scintigrafia con octreotide marcato con indio radioattivo (octreoscan); determinazione del livello di ACTH nel sangue venoso prelevato a vari livelli del sistema venoso.
Diagnosi differenziale effettuato in 2 fasi.
Stadio 1: differenziazione di condizioni simili all'ipercortisolismo in termini di manifestazioni cliniche (dispituitarismo puberale, diabete mellito di tipo 2 nelle donne con obesità e sindrome menopausale, sindrome dell'ovaio policistico, obesità, ecc.). La differenziazione dovrebbe basarsi sui criteri di cui sopra per la diagnosi di ipercortisolismo. Inoltre, va ricordato che l'obesità grave nell'ipercortisolismo è rara; inoltre, con l'obesità esogena, il tessuto adiposo è distribuito in modo relativamente uniforme e non è localizzato solo sul tronco. Quando si esamina la funzione della corteccia surrenale in pazienti senza ipercortisolismo, di solito vengono rilevate solo violazioni minori: il livello di cortisolo nelle urine e nel sangue rimane normale; il ritmo quotidiano del suo livello nel sangue e nelle urine non è disturbato.
Fase 2: diagnosi differenziale per chiarire la causa dell'ipercortisolismo con l'implementazione degli studi di cui sopra. Va tenuto presente che la gravità dell'ipercortisolismo iatrogeno è determinata dalla dose totale di steroidi somministrati, dall'emivita biologica del farmaco steroideo e dalla durata della sua somministrazione. Nei soggetti che ricevono steroidi nel pomeriggio o alla sera, l'ipercortisolismo si sviluppa più velocemente e con dosi giornaliere inferiori di farmaci esogeni rispetto ai pazienti la cui terapia è limitata alle sole dosi mattutine o all'uso di una tecnica alternata. Le differenze nella gravità dell'ipercortisolismo iatrogeno sono determinate anche dalle differenze nell'attività degli enzimi coinvolti nella degradazione degli steroidi somministrati e nel loro legame.
Un gruppo separato per la diagnosi differenziale sono le persone in cui la tomografia computerizzata (10-20%) rivela accidentalmente neoplasie surrenali senza segni di attività ormonale (insendentalomi), che raramente sono maligne. La diagnosi si basa sull'esclusione dell'attività ormonale in termini di livello e ritmo circadiano del cortisolo e di altri steroidi surrenali. La gestione di Incedental è determinata dal tasso di crescita e dalle dimensioni del tumore (il carcinoma surrenalico raramente ha un diametro inferiore a 3 cm e gli adenomi surrenalici di solito non raggiungono i 6 cm).
Trattamento
La tattica del trattamento è determinata dalla forma dell'ipercortisolismo.
Nel caso di ipercortisolismo centrale ACTH-dipendente e la rilevazione di adenoma ipofisario, l'adenomectomia transfenoidale selettiva è il trattamento preferito e, in caso di macroadenoma, l'adenomectomia transcranica. Il postoperatorio, nonostante la necessità di una terapia sostitutiva, è considerato un effetto favorevole, poiché una terapia adeguata fornisce una compensazione e una qualità della vita incomparabilmente superiore rispetto all'ipercortisolismo.
In assenza di un adenoma ipofisario con ipercortisolismo centrale ACTH-dipendente, vengono utilizzate varie opzioni per la radioterapia nella regione ipofisaria. Il metodo preferito di radioterapia è la terapia protonica alla dose di 40-60 Gy.
In assenza di un microadenoma ipofisario, vengono prescritti inibitori della steroidogenesi: derivati di orto-para-DDT (cloditan, mitotane), aminoglutethemide (orimethen, mamomit, elipten), ketoconazolo (nizoral alla dose da 600-800 mg / die a 1200 mg/die sotto il controllo del cortisolo).
In assenza di effetto terapeutico, è possibile eseguire surrenectomia unilaterale e persino bilaterale (laparoscopica o "aperta"). Negli ultimi anni, la surrenectomia bilaterale viene raramente eseguita a causa del possibile sviluppo (crescita progressiva dell'adenoma ipofisario che produce ACTH).
Se viene rilevata una formazione volumetrica della ghiandola surrenale con attività ormonale, che determina la sindrome dell'ipercortisolismo, viene indicato un trattamento chirurgico, tenendo conto delle dimensioni del tumore e della sua relazione con organi e tessuti circostanti. Se vi è evidenza di crescita maligna del carcinoma adrenocorticale dopo il trattamento chirurgico, viene utilizzata la chemioterapia con inibitori della steroidogenesi.
Il trattamento della sindrome ACTH-ectopica viene effettuato a seconda della posizione e dello stadio del tumore primario, tenendo conto della gravità dell'ipercortisolismo. In presenza di metastasi, la rimozione del tumore primario non è sempre giustificata, la soluzione di questo problema è prerogativa degli oncologi chirurgici. Per ottimizzare le condizioni del paziente ed eliminare l'ipercortisolismo, è possibile utilizzare la terapia con inibitori della steroidogenesi.
Con l'ipercorticismo iatrogeno, è necessario ridurre al minimo la dose di glucocorticoidi o annullarli completamente. Di fondamentale importanza è la gravità della patologia somatica, che è stata trattata con glucocorticoidi. Parallelamente, è possibile prescrivere una terapia sintomatica volta ad eliminare le violazioni identificate.
La necessità di terapia sintomatica (farmaci antipertensivi, spironolattone, farmaci di potassio, farmaci ipoglicemizzanti, farmaci anti-osteoporotici) determina la gravità delle condizioni del paziente con ipercorticismo. L'osteoporosi steroidea è un problema urgente, pertanto, oltre ai preparati di calcio e vitamina D, viene prescritta una terapia antiriassorbimento con bifosfonati (alendronato, risendronato, ibandronato) o miocalcica.
Previsione
La prognosi è determinata dalla forma dell'ipercortisolismo e dall'adeguatezza del trattamento. Con un trattamento tempestivo e corretto, la prognosi è favorevole, ma la gravità dell'ipercortisolismo determina il grado di prognosi negativa.
I principali rischi di un outlook negativo:
- possibile sviluppo e progressione della patologia cardiovascolare (infarto, ictus, insufficienza circolatoria);
- osteoporosi con compressione dei corpi vertebrali, fratture patologiche e ridotta attività motoria dovuta a miopatia;
- diabete mellito con le sue complicanze "tardive";
- immunosoppressione e sviluppo di infezioni e/o sepsi.
D'altra parte, la prognosi per le forme tumorali di ipercortisolismo dipende dallo stadio del processo tumorale.
L'ipercortisolismo è una malattia che si sviluppa in violazione del sistema ipotalamo-ipofisario e ha un decorso multisintomatico.
Questa malattia è stata scoperta e studiata da due scienziati: il neurochirurgo Harvey Cushing in America e il neuropatologo Nikolai Itsenko a Odessa. In loro onore, l'ipercortisolismo è altrimenti chiamato malattia di Itsenko-Cushing.
Gli ormoni glucocorticosteroidi sono necessari per il metabolismo nel corpo, ma quando aumentano, possono comparire vari cambiamenti nel corpo.
Come si manifesta questa malattia?
I sintomi principali che compaiono più spesso sono:
- obeso;
- Aumento della pressione sanguigna;
- debolezza muscolare;
- Violazione della funzione sessuale;
- Sulla pelle possono comparire macchie di pigmento;
- Alle donne crescono i peli sul petto e sul viso.
L'obesità in tali pazienti ha un aspetto peculiare, cioè il grasso sottocutaneo si accumula in misura maggiore nella regione sopraclavicolare, nelle spalle e nelle vertebre cervicali e aumenta anche l'addome. Come risultato della ridistribuzione del tessuto adiposo, le braccia e le gambe si assottigliano, i muscoli si atrofizzano. Il viso assume una forma "a luna", la pelle diventa secca e squamosa, compaiono piaghe difficili da trattare, le guance sono rosso porpora. Altri sintomi includono smagliature sul petto, fianchi, addome, che sono rosse o viola.
La manifestazione più pericolosa nell'ipercortisolismo è una violazione del cuore e dei vasi sanguigni, a causa di ciò si verifica una sindrome di ipertensione arteriosa. Con un aumento della pressione, compaiono mal di testa, "mosche" lampeggianti davanti agli occhi. A causa di un fallimento metabolico, possono svilupparsi diabete mellito, osteoporosi, che è molto difficile.
L'ipercortisolismo porta a una significativa diminuzione dell'immunità, che funge da catalizzatore per la comparsa di ulcere, pustole, pielonefrite, infezioni fungine delle unghie e della pelle. Inoltre, i sintomi includono una violazione del sistema nervoso, potrebbero esserci disturbi del sonno, cattivo umore, psicosi.
Nelle ragazze, dopo l'inizio del ciclo mestruale, può verificarsi amenorrea (una condizione in cui non ci sono mestruazioni). C'è un ritardo nella crescita e nello sviluppo sessuale, la voce diventa ruvida.
Come risultato di ciò che può svilupparsi la malattia?
Le cause di questa malattia non sono state ancora completamente identificate, ma è stato stabilito che nel gentil sesso la malattia di Itsenko-Cushing si verifica dieci volte più spesso che nei maschi.
Una tale malattia può svilupparsi in qualsiasi fascia di età, ma più spesso si ammalano in 20-40 anni.
Le cause possono essere varie lesioni alla testa e lesioni cerebrali (educazioni, infiammazioni), gravidanza, neuroinfezione, tumori delle ghiandole surrenali, del pancreas, dei polmoni, dei bronchi. La causa principale è considerata un adenoma della ghiandola pituitaria anteriore.
Come identificare l'ipercortisolismo?
 Il medico deve esaminare il paziente, intervistare, quindi la diagnostica di laboratorio è già stata eseguita. Con il suo aiuto, vengono determinate la secrezione giornaliera di cortisolo nel flusso sanguigno e la quantità di cortisolo libero nelle urine quotidiane.
Il medico deve esaminare il paziente, intervistare, quindi la diagnostica di laboratorio è già stata eseguita. Con il suo aiuto, vengono determinate la secrezione giornaliera di cortisolo nel flusso sanguigno e la quantità di cortisolo libero nelle urine quotidiane.
Per identificare l'ipercortisolismo della malattia, è necessario condurre un piccolo test con desametasone. Grazie ad esso, è possibile rilevare un tumore pituitario.
Un altro adenoma ipofisario è determinato dall'esame a raggi X delle ossa del cranio, della TC e della risonanza magnetica del cervello. Utilizzando tali studi diagnostici, è possibile determinare la posizione del tumore, le sue dimensioni, la crescita e con quali tessuti viene a contatto, il che è necessario per prescrivere il trattamento corretto per esso.
Inoltre, è necessario studiare le ghiandole surrenali utilizzando ultrasuoni, risonanza magnetica e tomografia computerizzata.
Cosa determina l'efficacia del trattamento?
L'ipercortisolismo può avere un rapido sviluppo, cioè tutti i sintomi compaiono entro 6-12 mesi e può esserci uno sviluppo graduale del quadro clinico nell'arco di 3-10 anni. Il trattamento dipenderà dalla diagnosi corretta, dalla gravità della malattia e dalla velocità con cui si sviluppano i sintomi. Il trattamento dovrebbe mirare all'eliminazione delle manifestazioni cliniche e alla normalizzazione dei livelli di cortisolo.
Con gravità moderata e lieve, vengono utilizzati farmaci che non consentono al corpo di produrre una quantità eccessiva di ormoni surrenali o viene prescritta la radioterapia, che riduce l'attività della ghiandola pituitaria. Se tutto ciò non dà l'effetto desiderato, viene utilizzato il trattamento chirurgico. Durante questo intervento, il tumore pituitario viene rimosso. O viene eseguita una surrenectomia, cioè la rimozione di una delle ghiandole surrenali, ma dopo tale operazione è necessaria una terapia sostitutiva costante.
Varietà di ipercortisolismo
Funzionale
L'ipercortisolismo funzionale si verifica a seguito di varie malattie che aumentano indirettamente il contenuto di cortisolo nel corpo. Tali disturbi includono: sindrome dell'ovaio policistico, obesità, cirrosi epatica, epatite cronica, anoressia, disturbi del sistema nervoso, depressione, alcolismo, gravidanza e pubertà sono altre cause di ipercortisolismo funzionale.
Secondario
L'ipercorticismo secondario nelle donne in gravidanza si sviluppa con un aumento dell'ormone adrenocorticotropo, responsabile del lavoro delle ghiandole surrenali. Innanzitutto, l'ipotalamo è colpito, quindi la ghiandola pituitaria è interessata e il suo tumore si sviluppa, appare un adenoma surrenale.
La sintomatologia è molto simile a quella dell'ipercortisolismo ordinario, il metabolismo è disturbato, il che può causare una violazione dello sviluppo e della crescita del feto e persino portare alla sua morte. La diagnosi viene effettuata sulla base di anamnesi, esame, esame craniografico a raggi X (la sella turca non aumenta molto, poiché i tumori corticotropi non sono grandi), viene eseguita la risonanza magnetica, vengono eseguiti esami di laboratorio degli ormoni, test ormonali con desametasone o metapiron usato.
Se una donna è rimasta incinta durante il periodo di tempo in cui aveva uno stadio attivo di ipercortisolismo secondario, dovrebbe essere eseguito un aborto. Per sopportare e dare alla luce un bambino, la malattia deve essere in remissione, quando la pressione sanguigna è normale, il metabolismo non è disturbato e viene eseguita la terapia sostitutiva. Solo il 30% delle donne con questa malattia può sopportare e dare alla luce un bambino.
 Durante la gravidanza, è necessario monitorare costantemente la pressione sanguigna, il peso corporeo, l'edema, i livelli ormonali, la minzione e determinare la quantità di zucchero nel sangue. Devi visitare un endocrinologo ogni tre mesi, seguire una dieta povera di sale e carboidrati, mangiare più frutta e vitamine.
Durante la gravidanza, è necessario monitorare costantemente la pressione sanguigna, il peso corporeo, l'edema, i livelli ormonali, la minzione e determinare la quantità di zucchero nel sangue. Devi visitare un endocrinologo ogni tre mesi, seguire una dieta povera di sale e carboidrati, mangiare più frutta e vitamine.
Alla nascita di un bambino di peso ridotto, con bassa pressione sanguigna e con un aumento degli ormoni corticosteroidi nelle urine, il medico prescrive farmaci glucocorticosteroidi, il bambino deve essere registrato presso un endocrinologo e un neuropatologo.
Endogeno
L'ipercortisolismo endogeno nell'80-85% dei casi si sviluppa con un tumore o iperplasia della ghiandola pituitaria. Succede:
- ipercortisolismo ACTH-dipendente;
- Sindrome ACTH-ectopica;
- ipercortisolismo ACTH-indipendente;
- corticosteroma;
- Iperplasia macronodulare della corteccia surrenale;
- Iperplasia micronodulare della corteccia surrenale.
Le manifestazioni cliniche includono obesità in giovane età, aumento della pressione sanguigna, osteoporosi, atrofia e debolezza muscolare, alterazioni trofiche della pelle, amenorrea, scarsa crescita nei bambini e comparsa di un tumore delle ghiandole surrenali.
subclinico
L'ipercortisolismo subclinico si sviluppa con un tumore delle ghiandole surrenali e si verifica nel 5-20% delle persone. Può essere determinato con un esame hardware (ecografia, risonanza magnetica, TC). Questa forma viene rilevata per caso, poiché non ci sono manifestazioni cliniche o sono meno pronunciate, il livello di cortisolo nelle urine quotidiane rientra nell'intervallo normale. Ma se al paziente viene prescritto un trattamento chirurgico, l'ipercortisolismo subclinico deve essere escluso in modo che non si verifichino complicanze postoperatorie.
La sindrome dell'ipercortisolismo (Cushing) è un processo patologico. Con questa malattia, i glucocorticoidi iniziano a essere rilasciati in eccesso nel corpo umano. Questi ormoni sono prodotti dalla corteccia surrenale.
La sindrome dell'ipercortisolismo (Cushing) è un processo patologico. Con questa malattia, i glucocorticoidi iniziano a essere rilasciati in eccesso nel corpo umano. Questi ormoni sono prodotti dalla corteccia surrenale. A causa del loro eccessivo rilascio nel corpo umano, si verificano disturbi metabolici, che portano all'obesità, un malfunzionamento delle gonadi nel gentil sesso, ipertensione arteriosa e irsutismo (crescita intensa di peli sul corpo della donna). La sindrome di Cushing colpisce spesso il corpo femminile.
1
Esistono 2 forme principali in cui si verifica l'ipercorticismo. Questo è primario, in cui la corteccia surrenale è danneggiata, così come l'ipercortisolismo secondario (funzionale), il cui decorso è associato a una violazione del normale funzionamento del sistema ipotalamo-ipofisario.
La sindrome di Cushing si verifica sullo sfondo di:
- iperplasia surrenale;
- neoplasie derivanti dalla corteccia surrenale;
- uso a lungo termine di farmaci contenenti glucocorticoidi;
- la presenza di iperplasia nodulare delle ghiandole surrenali.

Nella maggior parte dei casi, l'insorgenza di tale disturbo è associata all'iperproduzione di ACTH (ormone adrenocorticotropo), che a sua volta porta alla formazione di iperplasia surrenale. Di conseguenza, l'organo interno inizia ad aumentare di dimensioni, ma allo stesso tempo mantiene la sua forma.
Circa il 10% dei pazienti con ipercortisolismo durante una visita medica rivela neoplasie tumorali sulla ghiandola pituitaria anteriore, che è il fattore che provoca la malattia. In tutti gli altri casi, la causa della sindrome di Cushing può essere un malfunzionamento dell'ipotalamo, che consiste nella produzione di una quantità eccessiva di corticoliberina.
Il rilascio di peptidi può essere un fattore che contribuisce al verificarsi di iperplasia della corteccia surrenale. Queste sostanze sono chimicamente e biologicamente inseparabili dagli ormoni adrenocorticotropi, che possono essere prodotti da alcune neoplasie maligne al di fuori della ghiandola surrenale, come il cancro del timo, del polmone e del pancreas.
2
Con l'ipercortisolismo, i sintomi portano al fatto che una persona ha:
- Obesità. Lo sviluppo di questo processo patologico è osservato in quasi tutti i pazienti. Il tessuto adiposo si forma principalmente su viso, collo, addome toracico e schiena. In questo caso, la carnagione del paziente ha una sfumatura rosso porpora.
- Deterioramento delle condizioni della pelle. In questo caso, l'epidermide diventa sottile, secca e squamosa. Le smagliature iniziano ad apparire sulla pelle, il cui verificarsi è spiegato dalla progressiva obesità e dalla rottura del collagene. Le smagliature possono essere rosse o viola. Possono manifestarsi sulla pelle delle cosce, dell'addome, delle spalle e della regione toracica e la larghezza dei difetti può raggiungere i 2 cm Sull'epidermide del paziente possono comparire eruzioni cutanee ed emorragie sottocutanee.
- Atrofia del tessuto muscolare. Questo fenomeno interessa principalmente gli arti inferiori e il cingolo scapolare. Il paziente non è in grado di muoversi normalmente.
- Osteoporosi. Questa malattia è una delle complicanze frequentemente osservate causate dall'ipercortisolismo. La malattia è caratterizzata da una maggiore fragilità del tessuto osseo a causa della mancanza di calcio nel corpo.
- Violazioni del sistema nervoso. Manifestato sotto forma di stato depressivo e inibizione della reazione del paziente.
- Cardiomiopatia. Questa patologia è caratterizzata dal verificarsi di fallimenti nel ritmo del cuore, che sono accompagnati da insufficienza cardiaca. Di solito la cardiomiopatia è la causa principale che porta alla morte del paziente.
- Interruzioni nel funzionamento del sistema ormonale. Tali fallimenti sono caratterizzati dal fatto che l'irsutismo inizia a svilupparsi nelle donne malate.

3
Per determinare se una persona ha ipercortisolismo, vengono utilizzati i seguenti test di laboratorio:
- Determinazione del contenuto giornaliero di cortisolo libero nelle urine del paziente. Se il livello di questa sostanza supera la norma di oltre 4 volte, questo indicatore indica la presenza della sindrome di Cushing.
- Un esame del sangue che misura i livelli di cortisolo.
- Condurre un piccolo test al desametasone. Quando si utilizza questa analisi di laboratorio, al paziente viene prescritto desametasone. Questo farmaco riduce il livello di cortisolo nel corpo. Se tale diminuzione non si verifica, ciò confermerà l'eccessivo rilascio di glucocorticoidi e la presenza di un processo patologico.
Per rilevare possibili neoplasie sulla corteccia surrenale e scoprire la causa principale della patologia, applicare:
- Risonanza magnetica o tomografia computerizzata. L'esecuzione di queste procedure diagnostiche consente di valutare le condizioni e le dimensioni delle ghiandole surrenali. Con l'aiuto della risonanza magnetica e della TC, è possibile determinare l'assenza o la presenza di neoplasie nell'organo interno.
- Radiografia del torace e della colonna vertebrale. Questo studio è in grado di rilevare l'osteoporosi e le sue manifestazioni (fratture delle costole, fratture da compressione delle vertebre) nel soggetto. Viene utilizzato anche un esame del sangue di laboratorio, con l'aiuto del quale vengono studiati i suoi indicatori.
Ulteriori procedure diagnostiche che consentono di identificare le complicanze causate dall'ipercortisolismo includono:
- Emianopsia bitemporale. Questo è un restringimento dei campi visivi, che consente di determinare la presenza di processi congestizi nei nervi ottici.
- Elettrocardiografia (ECG). L'esecuzione di tale procedura consente di rilevare i segni caratteristici della distrofia miocardica.
- Visita ginecologica. Permette di valutare la condizione delle ovaie e dell'utero di una donna malata.
- Densitometria ossea. Con l'aiuto di questo esame, è possibile determinare lo stadio di sviluppo dell'osteopenia o dell'osteoporosi.

4 Metodi di trattamento del processo patologico
Il metodo di trattamento della sindrome di Cushing dipende interamente dalla forma in cui procede la malattia. Se la patologia è stata causata dall'assunzione di farmaci contenenti glucocorticoidi, come trattamento è necessaria la loro graduale cancellazione con sostituzione con altri farmaci.
Se l'inizio del processo patologico è stato provocato dalla presenza di neoplasie tumorali localizzate nella regione delle ghiandole surrenali, dei polmoni o della ghiandola pituitaria, viene prescritto un intervento chirurgico, con l'aiuto del quale vengono rimosse le neoplasie. Per consolidare e migliorare l'effetto, il trattamento chirurgico è spesso combinato con la radioterapia.
Nel caso della natura endogena dell'insorgenza di ipercortisolismo, il suo trattamento prevede l'uso di farmaci che sopprimono l'eccessivo rilascio di ormoni. Questi farmaci includono Mitotan, Aminoglutethimide, Ketoconazole e Chloditan.
Il corso del trattamento sintomatico comprende l'uso di farmaci diuretici, ipotensivi, cardiaci e ipoglicemizzanti, nonché immunomodulatori, biostimolanti e vari antidepressivi.
La sindrome dell'ipercortisolismo è un grave processo patologico che, senza un trattamento tempestivo, può portare a cambiamenti irreversibili nel corpo umano e persino alla morte.
Il contenuto dell'articolo
Ipercortisolismo (malattia e sindrome di Itsenko-Cushing) osservato con rilascio eccessivo di glucocorticoidi da parte della corteccia surrenale ed è caratterizzato dallo sviluppo di obesità, ipertensione arteriosa, iperglicemia e altri disturbi metabolici. La malattia è più comune nelle donne.Eziologia e patogenesi dell'ipercortisolismo
Esistono ipercortisolismo primario dovuto a danni alla corteccia surrenale e ipercorticismo secondario associato a disfunzione del sistema ipotalamo-ipofisario. Nel 75-80% dei casi, l'ipercortisolismo è causato da un'eccessiva secrezione di ACTH (malattia di Itsenko-Cushing), che porta all'iperplasia della corteccia surrenale. Nel 10% di tali pazienti si trova un adenoma della ghiandola pituitaria anteriore. In altri casi, c'è una disfunzione dell'ipotalamo, che secerne una grande quantità di corticoliberina. La sindrome di Itsenko-Cushing può essere causata da adenoma o adenocarcinoma della corteccia surrenale. Inoltre, l'iperplasia della corteccia surrenale è causata da peptidi biologicamente e chimicamente inseparabili dall'ACTH, prodotti dalle cellule di alcuni tumori maligni a localizzazione extrasurrenale (tumore del polmone, del timo, del pancreas, ecc.). La sindrome della produzione ectopica di ACTH è più comune negli uomini di mezza età e anziani. L'adenocarcinoma della corteccia surrenale è spesso la causa dell'ipercortisolismo nei bambini. La sindrome di Itsenko-Cushing si sviluppa anche con l'uso prolungato di glucocorticoidi nelle malattie di natura autoimmune e allergica, malattie del sangue, ecc.Clinica di ipercortisolismo
I pazienti lamentano mal di testa, affaticamento, debolezza, disfunzione sessuale. L'obesità è caratteristica con una deposizione predominante di grasso sul viso, che acquisisce una forma arrotondata "a forma di luna", busto, nella parte posteriore del collo, sopra le clavicole. Allo stesso tempo, gli arti diventano più sottili a causa non solo della ridistribuzione del grasso, ma anche dell'atrofia muscolare (l'effetto catabolico dei glucocorticoidi sul metabolismo delle proteine). Si sviluppa l'atrofia della pelle, sulla quale compaiono facilmente emorragie - ecchimosi. Sulla pelle dell'addome, principalmente nelle sezioni laterali inferiori, si formano strisce rosate - strie. I glucocorticoidi causano anche lo sviluppo dell'osteoporosi, che si manifesta con dolore alle ossa e alle articolazioni e talvolta con fratture spontanee delle ossa tubolari, delle costole e della colonna vertebrale. In 3/4 dei pazienti si osserva ipertensione arteriosa, che può essere abbastanza persistente. L'aumento della pressione sanguigna è dovuto ad un aumento del volume del sangue circolante e ad un aumento dell'azione delle catecolamine sotto l'influenza dei glucocorticoidi. Molti pazienti sviluppano la distrofia miocardica, accompagnata da alterazioni dell'ECG e in 1/4 dei pazienti - insufficienza cardiaca. Il metabolismo dell'acqua-elettrolita è disturbato: compaiono edema e ipopotassiemia, l'escrezione di calcio aumenta e il suo assorbimento nell'intestino è disturbato, il che contribuisce alla progressione dell'osteoporosi. La maggior parte dei pazienti presenta disturbi psico-emotivi: irritabilità, irritabilità, labilità emotiva, a volte grave depressione e psicosi. Un aumento della secrezione di androgeni porta a irsutismo, acne e irregolarità mestruali nelle donne. Negli uomini si sviluppa l'impotenza, la libido diminuisce a causa dell'effetto inibitorio dell'idrocortisone sulle cellule di Leydig. Spesso si osservano dolori addominali, le ulcere gastriche si sviluppano più spesso, il che è particolarmente caratteristico della sindrome da droga di Itsenko-Cushing. La tolleranza al glucosio è solitamente ridotta, alcuni pazienti sviluppano diabete mellito, che, di norma, è relativamente lieve e raramente complicato da chetoacidosi.Nel sangue si riscontrano neutrofilia moderata, a volte eritrocitosi, ipokaliemia, ipocloremia e alcalosi metabolica. La radiografia rivela un'osteoporosi generalizzata, in particolare della colonna vertebrale e delle ossa pelviche.Diagnosi e diagnosi differenziale dell'ipercortisolismo
La malattia e la sindrome di Cushing devono essere sospettate in presenza di obesità, strie, irsutismo, ipertensione arteriosa e osteoporosi. In tali pazienti, il contenuto di idrocortisone e 17-idrossicorticosteroidi nel sangue e l'escrezione di 17-idrossicorticosteroidi nelle urine sono aumentati. In alcuni pazienti aumenta anche l'escrezione di 17-chetosteroidi. Per la diagnosi differenziale della malattia e della sindrome di Itsenko-Cushing vengono utilizzati campioni con desametasone (test Liddle piccolo e grande) e metopirone. Quando si esegue un piccolo test Liddle, al paziente viene prescritto il desametasone, che blocca la secrezione di ACTH, 0,5 mg ogni 6 ore per 2 giorni. In presenza di ipercorticismo, l'escrezione di 17-idrossicorticosteroidi prima e dopo l'assunzione del farmaco non differisce significativamente, mentre nelle persone sane dopo il test diminuisce. Un metodo più semplice per diagnosticare l'ipercortisolismo consiste nel determinare il livello di idrocortisone nel sangue alle 8 del mattino dopo aver assunto 1 mg di desametasone intorno a mezzanotte. Nelle persone sane, il livello di idrocortisone è significativamente inferiore rispetto all'ipercortisolismo. Quando si esegue un test Liddle di grandi dimensioni, il paziente assume desametasone 2 mg ogni 6 ore per 2 giorni. Con la malattia di Itsenko-Cushing, l'escrezione di 17-idrossicorticosteroidi nelle urine diminuisce del 50% o più rispetto al livello iniziale, mentre con i tumori delle ghiandole surrenali e la sindrome della produzione ectopica di ACTH non cambia. Il metopirone, che blocca l'11-idrossilasi, viene somministrato per via orale a 750 mg ogni 6 ore per 2 giorni. Con la malattia di Itsenko-Cushing, l'assunzione del farmaco porta ad un aumento dell'escrezione di 17-idrossicorticosteroidi nelle urine e con la sindrome di Itsenko-Cushing non cambia.Di grande importanza diagnostica è la determinazione del livello di ACTH nel sangue mediante RIA. Con un tumore della corteccia surrenale, è ridotto e con la malattia di Itsenko-Cushing e, in misura ancora maggiore, la sindrome della produzione ectopica di ACTH, è aumentato. Con danni alla ghiandola pituitaria, aumenta l'escrezione di 17-idrossicorticosteroidi e 17-chetosteroidi, poiché in tali pazienti aumenta la secrezione di tutti gli ormoni steroidei, inclusi gli androgeni. Nella sindrome da produzione ectopica di ACTH, l'escrezione di 17-idrossicorticosteroidi aumenta prevalentemente. Con un tumore benigno della corteccia surrenale, il rilascio di 17-chetosteroidi è normale e con l'adenocarcinoma è solitamente aumentato.
Per rilevare i tumori delle ghiandole surrenali, viene utilizzata la tomografia computerizzata, che è un metodo più informativo rispetto all'arteriografia e alla scansione con radioisotopi delle ghiandole surrenali utilizzando lo iodocolesterolo. Se la dimensione della ghiandola surrenale supera i 4 cm, la diagnosi di adenocarcinoma è molto probabile, se è inferiore a 4 cm - adenoma della ghiandola. Con un alto livello di ACTH nel sangue, viene eseguita la tomografia computerizzata della ghiandola pituitaria. In assenza di un tumore ipofisario, si deve sospettare un tumore extrasurrenale che produce ACTH. Una caratteristica della sindrome della produzione ectopica di ACTH è la frequente assenza di segni clinici pronunciati di ipercortisolismo. Il sintomo caratteristico è l'ipokaliemia.
Manifestazioni separate della sindrome di Itsenko-Cushing sono osservate nell'obesità, nell'alcolismo cronico. Con l'obesità esogena, il grasso è solitamente distribuito uniformemente. Il contenuto di idrocortisone e dei suoi metaboliti nel sangue e nelle urine è leggermente cambiato, il ritmo giornaliero della secrezione di idrocortisone è stato preservato. Nei pazienti con alcolismo, l'interruzione dell'assunzione di alcol di solito porta alla scomparsa di sintomi simili a quelli della malattia di Itsenko-Cushing.
La sindrome da ipercortisolismo (codice ICD 10) è un complesso di sintomi che si manifestano sotto l'influenza di una maggiore sintesi dell'ormone della corteccia surrenale.
La patologia può manifestarsi a qualsiasi età in qualsiasi genere.
La sindrome differisce dalla malattia in quanto nel secondo caso l'ipercortisolismo si verifica una seconda volta e la patologia della ghiandola pituitaria è primaria.
In medicina esistono tre tipi di ipercortisolismo, che si basano sulla differenza nelle cause della patologia:
- esogeno;
- endogeno;
- pseudosindrome.
Nella pratica medica ci sono anche casi di sindrome giovanile di ipercortisolismo. Anche l'ipercortisolismo giovanile viene individuato come un tipo separato ed è dovuto a cambiamenti ormonali legati all'età nel corpo di un adolescente.
Esogeno
Sotto l'influenza di cause esterne, come l'uso per il trattamento di farmaci contenenti glucocorticoidi, può svilupparsi ipercorticismo iatrogeno o esogeno.
Fondamentalmente, scompare dopo l'abolizione del farmaco che provoca la patologia.
Endogeno
I fattori nello sviluppo dell'ipercortisolismo endogeno possono essere i seguenti motivi:
- (microadenoma della ghiandola pituitaria);
- tumori bronchiali;
- tumori testicolari;
- tumori ovarici;
- tumore o.
Il tumore provocatorio dei bronchi o delle gonadi è spesso il corticotropinoma ectopico. È lei che provoca un aumento della secrezione dell'ormone corticosteroide.

Sindrome pseudo-Itsenko-Cushing
L'ipercorticismo falso si verifica per i seguenti motivi:
- alcolismo;
- gravidanza;
- prendere contraccettivi orali;
- obesità;
- stress o depressione prolungata.
La causa più comune della pseudo-sindrome è l'avvelenamento da alcol grave. Tuttavia, non ci sono tumori.
Fattori di rischio
Sintomaticamente, la sindrome si manifesta con i seguenti segni specifici:
- Obesità, con una pronunciata deposizione di grasso su viso, collo, addome. In questo caso, gli arti diventano più sottili. La sindrome è caratterizzata da una faccia a forma di luna.
- Rossore malsano delle guance che non va via.
- Le smagliature bluastre compaiono sull'addome.
- Potrebbe apparire l'acne.
- Si verifica l'osteoporosi.
- Disturbi nel lavoro del sistema cardiovascolare, ipertensione.
Disturbi come la depressione o le emicranie prolungate possono essere sia la causa dell'ipercortisolismo che i suoi sintomi. Inoltre, l'appetito con una tale violazione del sistema endocrino diventa spesso esorbitante.
Un paziente affetto dalla sindrome di Itsenko-Cushing è caratterizzato dalla presenza di pigmentazione nei punti in cui i vestiti sfregano spesso la pelle.

Giovanile
L'ipercortisolismo nei bambini si verifica a causa dell'iperplasia della corteccia surrenale. I sintomi di questa malattia possono comparire già da un anno.
In presenza di sintomi caratteristici, simili ai segni della sindrome negli adulti, nei bambini si verificano le seguenti manifestazioni:
- suscettibilità alle malattie;
- scarso sviluppo delle capacità mentali;
- scarso sviluppo fisico;
- cardiopatia.
Se la malattia si è manifestata prima dell'adolescenza, può iniziare la pubertà precoce. Se la malattia si è manifestata nell'adolescenza, allora ci sarà un ritardo nello sviluppo sessuale.
Se un neonato mostra tutti i segni della patologia, allora è del tutto possibile che lo abbia. In oltre l'80% delle malattie con la sindrome di Itsenko-Cushing di età inferiore a un anno, la causa è un tumore benigno della corteccia surrenale.
Tra le donne
Le donne hanno una probabilità 10 volte maggiore rispetto agli uomini di sviluppare la sindrome da ipercortisolismo. La principale fascia di età dei pazienti è la mezza età.
Nelle donne si manifesta con i seguenti sintomi:
- Aumento della pelosità su labbra, petto, braccia e gambe.
- C'è amenorrea, anovulazione.
- L'ipercortisolismo nelle donne in gravidanza provoca un aborto spontaneo o l'insorgenza di malattie cardiache in un bambino.
Le donne hanno maggiori probabilità degli uomini di sviluppare forme gravi di osteoporosi. Infatti, una tale manifestazione della malattia può portare a gravi forme di disabilità anche prima dell'inizio della menopausa.
La sindrome dell'ipercortisolismo porta ad una diminuzione della libido sia nelle donne che negli uomini. In quest'ultimo, si manifesta anche con l'impotenza.

Tipi di ipercortisolismo
Nella tipologia della sindrome di Itsenko-Cushing si distinguono due tipi di patologia: primaria e secondaria.
L'ipercortisolismo primario viene rilevato in violazione delle ghiandole surrenali stesse, con la comparsa di un tumore funzionale della corteccia. Tali neoplasie possono verificarsi anche in altri organi, ad esempio le gonadi.
L'ipercortisolismo secondario è associato a cambiamenti nella ghiandola pituitaria, quando le neoplasie nel sistema ipotalamo-ipofisario provocano un aumento ormonale.
Come può procedere la sindrome?
La patologia può essere nascosta, con un leggero aumento della sintesi ormonale, e pronunciata.
I medici distinguono tre forme di manifestazione della malattia:
- Ipercortisolismo subclinico, si verifica in una fase iniziale o con piccole forme di tumori, manifestate da aumento della pressione sanguigna, disfunzione delle gonadi.
- iatrogeno si verifica a causa dell'esposizione a un farmaco per il trattamento delle malattie reumatiche, il sangue. Nel trapianto di organi, viene rilevato nel 75% dei casi.
- Funzionale o endogeno l'ipercortisolismo è rilevato in gravi patologie della ghiandola pituitaria, nel diabete mellito. I pazienti con giovinezza richiedono un monitoraggio speciale.
Fino al 65% dei casi è ipercortisolismo iatrogeno.
Gradi
Secondo la gravità del decorso della malattia, si distinguono tre gradi:
- Lieve con lieve obesità, stato normale del sistema cardiovascolare.
- Media con lo sviluppo di problemi alle ghiandole endocrine, aumento di peso di oltre il 20% del proprio peso corporeo.
- Grave con lo sviluppo di gravi complicanze e grave obesità.
In base al tasso di sviluppo della malattia e alle sue complicanze, è possibile distinguere: una forma progressiva (il periodo di sviluppo della patologia è di sei mesi - un anno) e una forma graduale (da 1,5 anni o più).

Diagnostica
I seguenti metodi sono usati per diagnosticare questa malattia:
- esame del sangue per e corticosteroidi;
- test delle urine ormonali;
- radiografia della testa, ossa dello scheletro;
- MRI o TC del cervello.
La diagnosi è fatta chiaramente in presenza di tutti gli studi. Dovrebbe essere differenziato dal diabete e dall'obesità.
Trattamento
Con ipercorticismo di forme diverse, è necessaria una terapia diversa:
- L'ipercortisolismo iatrogeno viene trattato con la sospensione dell'ormone.
- Quando si verifica l'iperplasia surrenalica, vengono utilizzati farmaci per sopprimere gli steroidi, come il ketoconazolo o il mitotan.
- Quando si verifica una neoplasia, vengono utilizzati un metodo chirurgico e la chemioterapia. In medicina, la radioterapia è usata per trattare il cancro delle ghiandole.
Applicare inoltre:
- diuretici;
- ipoglicemizzante;
- immunomodulatori;
- sedativi;
- vitamine, calcio.
Se al paziente sono state rimosse le ghiandole surrenali, dovrà farlo per il resto della sua vita.
Il metodo moderno della laparoscopia viene utilizzato nei casi di surrenalectomia. È sicuro per il paziente e ha un periodo minimo di riabilitazione.
Complicazioni
In assenza di trattamento o del rapido decorso della malattia, possono verificarsi complicazioni potenzialmente letali per il paziente:
- disturbi nel lavoro del cuore;
- emorragia nel cervello;
- avvelenamento del sangue;
- forme gravi di pielonefrite con necessità di emodialisi;
- lesioni ossee, inclusa una frattura dell'anca o una frattura spinale.
È considerata una condizione che richiede un intervento tempestivo per fornire assistenza. Porta a gravi danni ai sistemi corporei e al coma. A sua volta, l'incoscienza può portare alla morte.
Prognosi del trattamento
La sopravvivenza e il recupero dipendono da.
Più spesso previsto:
- La percentuale di morte sarà fino alla metà di tutti i casi di ipercortisolismo endogeno diagnosticato ma non trattato.
- Quando viene diagnosticato un tumore maligno, fino a 1/4 di tutti i pazienti che lo curano sopravvivono. Altrimenti, la morte avviene entro un anno.
- Con un tumore benigno, la possibilità di recupero arriva fino a 3/4 di tutti i pazienti.
I pazienti con dinamiche positive del decorso della malattia devono essere osservati da uno specialista per tutta la vita. Con il monitoraggio dinamico e l'assunzione dei farmaci necessari, queste persone conducono una vita normale senza perdere la sua qualità.