Dermatite atopica: basi della diagnosi e ruolo dei cosmetici medicinali nella terapia. Dermatite atopica: basi della diagnosi e ruolo dei cosmetici medicinali nella terapia Organizzazione dell'adattamento del personale come metodo per migliorare il servizio alberghiero
Per valutare la gravità della dermatite atopica (), esame della disabilità, è importante determinare la forma clinica, l'area del danno, l'intensità del prurito e il grado di disturbo del sonno. A questo proposito, il sistema di punteggio di gravità - SCORAD (punteggio della dermatite atopica - scala della dermatite atopica), sviluppato da un gruppo di scienziati provenienti da paesi europei, merita attenzione, studio e implementazione.
Fase I
Determinazione e valutazione dei segni di intensità (sintomi oggettivi)
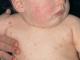
Il sistema SCORAD identifica 6 segni: 1) eritema (), 2) edema/papulogenesi, 3) essudazione/croste, 4) escoriazioni, 5) lichenificazione, 6) secchezza.
Ad ogni segno viene assegnato un punteggio da 0 a 3 punti (0 - assente, 1 - lieve, 2 - moderato, 3 - grave) in base alle fotografie consigliate. Non sono ammessi mezzi voti. I punteggi vengono forniti in un'apposita tabella dei punteggi, quindi l'indice SCORAD complessivo viene calcolato utilizzando la formula seguente.
L'area selezionata per la valutazione dovrebbe rappresentare, con intensità media, ciascun sintomo in un dato paziente, escludendo quindi l'area target o l'area di maggiore coinvolgimento. Tuttavia, la stessa area può essere selezionata per 2 o più funzioni. Ad esempio, la stessa area può essere utilizzata per valutare sia l'escoriazione che l'eritema. D'altra parte, la secchezza può esprimersi in aree che non presentano eruzioni acute o lichenificazione.
Valutazione delle caratteristiche:
Eritema o arrossamento (Fig. 1-3). Determinare questo segno sulla pelle chiara non è un problema. Se il punteggio non è possibile, indicarlo nelle note a piè di pagina della tabella dei punteggi.
Edema, formazione di papule (Fig. 4-6). Per edema/papulogenesi si intende un'infiltrazione palpabile della pelle, che può verificarsi sia nell'eritematosi acuta, nelle aree di escoriazione, sia nelle eruzioni cutanee croniche durante una riacutizzazione. Questo segno è difficile da determinare dalle fotografie cliniche. Pertanto, la palpazione della lesione dovrebbe essere presa in considerazione quando si valuta questo segno.
Piangente/crosta (Fig. 7-9). Questo segno si applica alle lesioni essudative derivanti da edema e vescicole. L'aspetto quantitativo dell'essudato può essere determinato mediante esame clinico e colloqui con i genitori, nonché dai livelli di albumina sierica in assenza di altra patologia.
Escoriazione (Fig. 10-12). Questo segno stesso è un indicatore oggettivo di prurito, più evidente nelle lesioni non lichenificate. Vengono illustrati il numero e l'intensità dei graffi per ciascun punteggio.
Lichenificazione (Fig. 13-15). Questo segno è simile all'ispessimento epidermico nelle lesioni croniche. Le pieghe della pelle fortemente pronunciate sono separate da aree lucide a forma di diamante, il colore è grigio-brunastro. I focolai pruriginosi e le grandi lesioni piegate sono suscettibili alla lichenificazione, che si osserva più spesso nei pazienti di età superiore ai 2 anni.
Secchezza. Quando possibile, questo segno dovrebbe essere valutato in aree lontane dai focolai di infiammazione e senza preventiva applicazione di emollienti o idratanti, anche su una scala a 3 punti. Le squame delle lesioni infiammatorie guarite non dovrebbero essere prese in considerazione. La palpazione è importante anche per valutare la ruvidità della pelle. È obbligatorio indicare se è presente una concomitante ittiosi vulgaris (sotto le note principali della scheda di valutazione). La presenza di screpolature è solitamente associata a grave secchezza delle estremità.
Fase II.
Calcolo dell'area delle lesioni cutanee
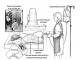
L'area della lesione viene valutata nei bambini secondo la regola del nove ed è raffigurata in dettaglio sul foglio di valutazione nei disegni dei contorni del corpo del bambino dalla parte anteriore e posteriore con aggiustamenti (relativi alla testa e alle estremità inferiori ) per pazienti di età inferiore a 2 anni (Fig. 16, 17). Le lesioni prese in considerazione dovrebbero presentare solo lesioni infiammatorie, ma non secchezza. Si prega di notare che un palmo del paziente costituisce l'1% dell'intera superficie cutanea.
Fase III.
Valutazione dei segni soggettivi
Questi includono prurito e disturbi del sonno. Il paziente (di solito di età superiore ai 7 anni) o i suoi genitori devono rispondere in modo completo e corretto alle vostre domande su questo argomento. Chiedere al paziente (o ai suoi genitori) di indicare sulla scala di 10 cm del modulo di valutazione il punto corrispondente al valore medio degli ultimi 3 giorni/notti. L'intensità del prurito e il grado di disturbo del sonno vengono valutati su una scala a 10 punti (da 0 a 10).
Fase IV
Calcolo del valore dell'indice SCORAD
Inserisci tutti i punti ricevuti sul referto. L’indice SCORAD si calcola utilizzando la formula:
SCORAD=A/5+7*B/2+C
, DoveA - area della pelle interessata, in%;
B—somma dei punteggi per i segni oggettivi (eritema, edema, trasudazione, escoriazioni, lichenificazione, secchezza);
C: somma dei punteggi per i sintomi soggettivi (prurito, perdita di sonno).
Esempio di calcolo.
Il paziente P., 12 anni, è stato ricoverato in clinica con una diagnosi di neurodermite diffusa, stadio acuto. L'area del danno alla pelle è del 65%. Valutazione dei sintomi oggettivi: eritema - 2 punti, gonfiore e papule - 2 punti, lacrimazione - 2 punti, escoriazioni - 3 punti, lichenificazione - 2 punti, secchezza - 2 punti. Totale: il punteggio di intensità totale dei sintomi oggettivi è di 13 punti.
Valutazione dei sintomi soggettivi: prurito - 8 punti, grado di disturbo del sonno - 7 punti. Totale: il punteggio totale dei sintomi soggettivi è di 15 punti.
L'indice SCORAD è 65/5 + 7*13/2 + 15 = 73,5 punti.
Nota. L'indice SCORAD dovrebbe essere calcolato prima e dopo il trattamento per valutare oggettivamente l'efficacia della terapia.
Indicatore C = ______________________________
Riso. 1. Scala SCORAD per valutare la gravità delle manifestazioni cliniche
I sintomi soggettivi - prurito cutaneo e disturbi del sonno - vengono valutati solo nei bambini di età superiore ai 7 anni. Al paziente o ai suoi genitori viene chiesto di indicare un punto all'interno di un righello di 10 centimetri che corrisponde, a loro avviso, alla gravità del prurito e dei disturbi del sonno, mediata negli ultimi 3 giorni. I punteggi dei sintomi soggettivi possono variare da 0 a 20.
Il punteggio complessivo è calcolato utilizzando la formula: A/5 + 7B/2 + C. Il punteggio totale della scala SCORAD può variare da 0 (nessuna manifestazione clinica di lesioni cutanee) a 103 (manifestazioni più gravi di dermatite atopica).
Quando l'indice SCORAD arriva fino a 20 punti, il decorso dell'AD è definito lieve, da 20 a 40 punti moderato e sopra i 40 punti grave.
Come valutare la gravità delle manifestazioni cliniche nei bambini di età inferiore a 7 anni?
Nei bambini di età inferiore a 7 anni, per determinare l'intensità delle manifestazioni cliniche, può essere utilizzato un indice SCORAD modificato - TIS (The Three Item Severity score), che viene determinato utilizzando parametri SCORAD simili A e B e calcolato utilizzando la formula A /5+7B/2.
I sintomi dovrebbero essere valutati sull’area della pelle dove sono più gravi. La stessa area della pelle interessata può essere utilizzata per valutare la gravità di un numero qualsiasi di sintomi. Il parametro C nei bambini di età inferiore a 7 anni non è determinato, data la piccola età dei soggetti, e quindi l'incapacità di valutare il grado delle sensazioni soggettive da parte del paziente stesso.
DIAGNOSTICA
Studi di laboratorio e strumentali
Analisi del sangue clinica (un segno non specifico può essere la presenza di eosinofilia; nel caso dell'aggiunta di un processo infettivo cutaneo, è possibile la leucocitosi neutrofila).
I test cutanei con allergeni (prick test, prick test) rilevano le reazioni allergiche IgE-mediate; effettuato da un allergologo in assenza di manifestazioni acute di dermatite atopica in un bambino. L'assunzione di antistaminici, antidepressivi triciclici e antipsicotici riduce la sensibilità dei recettori cutanei e può portare a risultati falsi negativi, pertanto questi farmaci devono essere interrotti rispettivamente 3-7 giorni e 30 giorni prima della data prevista per lo studio.
La determinazione della concentrazione di IgE totali nel siero del sangue ha un basso valore diagnostico (basso livello di IgE totali non indica l'assenza di atopia e non costituisce un criterio per escludere la diagnosi ANNO DOMINI).
La prescrizione di una dieta di eliminazione, nonché la somministrazione diagnostica del prodotto, viene solitamente effettuata da medici specialisti (allergologi, nutrizionisti) per confermare/escludere allergie alimentari (soprattutto nei casi di sensibilizzazione a
cereali e proteine del latte vaccino)1. L'efficacia diagnostica di una dieta di eliminazione viene valutata nel tempo, solitamente 2-4 settimane dopo la stretta aderenza alle raccomandazioni dietetiche. Ciò è dovuto alla patogenesi della dermatite atopica e alla velocità di risoluzione delle sue principali manifestazioni. La provocazione con allergeni alimentari (introduzione diagnostica del prodotto) è necessaria per confermare la diagnosi e nel tempo per valutare la formazione di tolleranza, nonché dopo la desensibilizzazione agli allergeni.
La diagnostica in vitro viene eseguita anche sotto la direzione di un allergologo e comprende la determinazione degli anticorpi IgE specifici per l'allergene nel siero del sangue, che è preferibile per i bambini:
- con manifestazioni cutanee comuni dell'AD;
- se è impossibile interrompere l'assunzione di antistaminici, antidepressivi triciclici, antipsicotici;
- con risultati discutibili dei test cutanei o in assenza di correlazione tra manifestazioni cliniche e risultati dei test cutanei;
- con un alto rischio di sviluppare reazioni anafilattiche a uno specifico allergene durante i test cutanei;
- per neonati;
- in assenza di allergeni per eventuali test cutanei - per la diagnosi in vitro.
ATTENZIONE! Gli esperti statunitensi ed europei in un documento di consenso sull'AD non raccomandano di utilizzare la determinazione del livello di IgG e delle sue sottoclassi durante l'esame dei pazienti con AD. Nel 2008, l’Accademia Europea di Allergologia e Immunologia Clinica ha concluso chiaramente che la determinazione delle IgG specifiche per gli allergeni alimentari non è clinicamente informativa.
Diagnosi differenziale
La dermatite atopica deve essere differenziata dalla scabbia, dalla dermatite seborroica, dalla dermatite allergica da contatto, dall'ittiosi, dalla psoriasi, dalle condizioni di immunodeficienza (sindrome di Wiskott-Aldrich, sindrome da iperimmunoglobulinemia E; Tabella 5).
1 Finora nella Federazione Russa non è stata sviluppata la tecnologia dei test provocativi, compresi i doppi test controllati con placebo, utilizzata per confermare la diagnosi all'estero, e la valutazione non è standardizzata.
Tabella 5.
Diagnosi differenziale della dermatite atopica nei bambini
Malattia |
Eziologia |
Natura dell'eruzione cutanea |
Localizzazione |
Insorgenza della malattia |
|||||||
Seborroico |
Eritematoso |
Parte pelosa |
Debole o |
Le prime settimane di vita |
|||||||
dermatite |
smerlato |
grappolo |
teste, nasolabiali |
assente |
|||||||
scaglie di grasso gialle |
pieghe, inguinali |
adolescenza |
|||||||||
Eritroderma |
Violazioni |
Diffondere |
eritema con |
abbondante |
Su tutta la superficie |
Debole o |
seno |
||||
fagocitosi |
desquamazione, diarrea, scarso guadagno |
torso, |
assente |
età |
|||||||
arti, viso |
|||||||||||
Pannolino |
Inadeguato |
Eritema, gonfiore, |
Perineo, glutei, cosce |
Assente |
|||||||
dermatite |
Assistenza ai bambini |
rash orticarioide, vescicole |
età |
||||||||
Papule e vescicole pruriginose, |
Pieghe interdigitali, |
Espresso |
Qualsiasi età |
||||||||
malattia |
posizionato linearmente, |
superfici di flessione |
|||||||||
pelle causata |
in coppia, caratteristico |
arti, zona inguinale, |
|||||||||
scabbia, graffi |
pancia, palme, piante dei piedi; A |
||||||||||
bambini piccoli - su |
|||||||||||
schiena e ascelle |
|||||||||||
depressioni |
|||||||||||
Pitiriasi rosea |
Virale |
Targa della madre a forma di rosa |
Superficie laterale |
Debolmente espresso |
|||||||
infezione, |
macchie dai contorni netti |
busto, schiena, |
adolescente |
||||||||
primavera Autunno |
successivi abbondanti |
spalle, fianchi |
|||||||||
piccole eruzioni cutanee rosa |
|||||||||||
macchie con leggera desquamazione |
|||||||||||
Ereditario |
Ereditario |
Iperemia, gonfiore, vescicole, |
Viso, estensore |
Forte prurito |
Gioventù, |
||||||
violazioni |
malattia |
essudazione, croste; nell'anziano |
superfici degli arti; |
vari |
accompagnamento |
||||||
età - iperemia, papule, |
busto, glutei, in età avanzata |
intensità |
neurologico |
||||||||
triptofano |
lichenificazione, escoriazione |
età - zona del collo, |
sintomi - |
||||||||
articolazioni, |
cerebellare |
||||||||||
superfici di flessione |
atassia, pancreatite |
||||||||||
arti, periorbitale |
|||||||||||
e localizzazione perianale |
|||||||||||
Ereditario |
Dermatite, |
ricordante |
Viso, pennelli |
Espresso |
nascita, da allora |
||||||
Viscotta– |
Legato all'X |
eritematoso-squamoso |
disponibilità |
||||||||
recessivo |
eruzioni cutanee, escoriazioni, essudazione |
trombocitopenia |
|||||||||
malattia |
e ricorrente |
||||||||||
infezioni |
|||||||||||
Genodermatosi |
Ipercheratosi follicolare, secchezza |
Torso, superiore e inferiore |
Debolmente espresso |
Primi mesi |
|||||||
fine-lamellare |
arti, palme, |
||||||||||
grande-lamellare |
peeling, |
unghie, capelli |
|||||||||
aumento della piegatura dei palmi; |
||||||||||
unghie e capelli fragili |
||||||||||
Microbico |
Sensibilizzazione |
Lesioni eritematose |
Più spesso asimmetrico |
Moderare, |
Qualsiasi età |
|||||
allo streptococco |
con confini chiari (1–3 cm) |
|||||||||
e stafilococco |
colore rosso intenso |
comune |
dolore |
|||||||
carattere |
||||||||||
Malattia |
Eziologia |
Natura dell'eruzione cutanea |
Localizzazione |
Insorgenza della malattia |
||||||
Multifattoriale |
Papule a rapida formazione |
Peloso |
Qualsiasi età |
|||||||
dermatosi |
placche ricoperte d'argento |
estensore |
superficie |
|||||||
ereditario |
bilancia |
articolazioni del gomito e del ginocchio, |
||||||||
predisposizione, |
così come su qualsiasi altro |
|||||||||
caratterizzato da |
aree della pelle |
|||||||||
iperproliferazione |
||||||||||
cellule epidermiche, |
||||||||||
violazione |
||||||||||
cheratinizzazione |
||||||||||
infiammatorio |
||||||||||
reazione nel derma |
||||||||||
Erpetiforme |
Senso |
Piccolo tempo |
Pelle del tronco, muscoli estensori |
Forte, ardente |
Età avanzata |
|||||
dermatite |
è aumentato |
vesciche su eritematoso |
superfici |
arti, |
||||||
sensibilità |
sfondo, inclinato |
|||||||||
senza glutine e celiachia |
al gruppo |
|||||||||
cellula T |
Maligno |
Nelle fasi iniziali - |
Sul busto e sugli arti |
Qualsiasi età |
||||||
linfoma cutaneo |
macchie gonfie di colore rosa brillante |
doloroso |
||||||||
all'inizio |
linfoide |
colori scrostati; |
||||||||
poi si formano le placche |
||||||||||
Indicazioni per consultazioni con specialisti
Dermatologo: stabilire una diagnosi, effettuare la diagnosi differenziale con altre malattie della pelle, selezionare e correggere la terapia ed educare il paziente.
Allergologo: condurre un esame allergologico, prescrivere una dieta di eliminazione, identificare allergeni causalmente significativi, selezionare e adattare la terapia, diagnosticare malattie allergiche concomitanti, educare il paziente e prevenire lo sviluppo di allergie respiratorie.
Una consultazione ripetuta con un dermatologo e un allergologo è necessaria anche in caso di scarsa risposta al trattamento con glucocorticoidi topici (MGC) o antistaminici, presenza di complicanze, decorso grave o persistente della malattia [uso a lungo termine o frequente di MGC forti, lesioni cutanee (20% della superficie corporea o 10% della pelle che coinvolge le palpebre, le mani, il perineo), il paziente presenta infezioni ricorrenti, eritroderma o lesioni esfoliative diffuse].
Nutrizionista: per creare e correggere una dieta individuale.
Medico ORL: identificazione e igiene dei focolai di infezione cronica, diagnosi precoce e sollievo tempestivo dei sintomi della rinite allergica.
Psiconeurologo: per prurito grave, disturbi comportamentali.
Psicologo medico: fornire trattamenti psicoterapeutici, insegnare tecniche di rilassamento, sollievo dallo stress e modificazione del comportamento.
ESEMPI DI DIAGNOSI
1. Dermatite atopica, forma comune, decorso grave, esacerbazione. Allergie alimentari.
2. Dermatite atopica, forma comune, decorso moderato, remissione incompleta.
3. Dermatite atopica, remissione.
Il trattamento dell'AD dovrebbe essere complesso e patogenetico, comprendendo misure di eliminazione, dieta, regime ipoallergenico, farmacoterapia locale e sistemica, correzione della patologia concomitante, educazione del paziente e riabilitazione. Il volume della terapia per l'AD è determinato dalla gravità delle manifestazioni cliniche (Fig. 2).
Il trattamento della dermatite atopica dovrebbe mirare al raggiungimento dei seguenti obiettivi: ridurre le manifestazioni cliniche della malattia, ridurre la frequenza delle riacutizzazioni, migliorare la qualità della vita dei pazienti e prevenire le complicanze infettive.
FARMACOTERAPIA DELLA DERMATITE ATOPICA
Terapia esternaè una parte obbligatoria e importante del trattamento completo dell’AD. Dovrebbe essere effettuato in modo differenziale, tenendo conto dei cambiamenti patologici della pelle. L'obiettivo della terapia esterna per l'AD non è solo alleviare l'infiammazione e
prurito, ma anche ripristino dello strato idrolipidico e della funzione barriera della pelle, oltre a garantire una corretta e quotidiana cura della pelle.

Riso. 2. Terapia a gradini per l'AD (Consensus EAACI / AAAAI / PRACTALL).
IV Fase:
III Fase:
Grave pressione sanguigna (SCORAD 40, persistente):
Immunosoppressori sistemici (GCS, ciclosporina A, azatioprina, tacrolimus, micofenolato mofetile), MGC ad attività moderata e alta, inibitori topici della calcineurina, antistaminici sistemici di 2a generazione, fototerapia.
Eventi educativi
Gravità moderata (SCORAD 20-40):
Antistaminici sistemici di 2a generazione. MHA di attività media e alta. Inibitori topici della calcineurina. Eventi educativi
II Fase: |
Gravità lieve (SCORAD)< 20): |
||
Antistaminici sistemici di 2a generazione. MGC basso e medio e |
|||
attività. Inibitori topici della calcineurina. |
|||
Eventi educativi |
|||
I Fase: |
|||
Solo pelle secca (remissione). |
|||
Terapia di base: cura della pelle, misure di eliminazione. |
|||
Eventi educativi |
|||
Nota: gli MGC sono glucocorticosteroidi locali.
Glucocorticosteroidi locali
Gli MGC sono farmaci di prima linea per il trattamento delle riacutizzazioni della dermatite atopica, nonché farmaci terapeutici iniziali per le forme moderate e gravi della malattia. Attualmente non esistono dati esatti riguardanti la frequenza ottimale delle applicazioni, la durata del trattamento, le quantità e le concentrazioni di MHA utilizzate per il trattamento della dermatite atopica D: sono determinate dalle caratteristiche della sostanza attiva utilizzata in un particolare preparato.
Non vi è alcuna prova chiara di benefici derivanti dall’applicazione di MHA due volte al giorno rispetto ad una volta al giorno. La frequenza di applicazione dell'MHA è determinata dalla farmacocinetica dello steroide: ad esempio, metilprednisolone aceponato e mometasone furoato devono essere utilizzati una volta al giorno, fluticasone - 1-2 volte al giorno, betametasone, prednisolone e idrocortisone 17-butirrato - 1- 3 volte al giorno, idrocortisone
2–3 volte al giorno.
La somministrazione di cicli brevi (3 giorni) di potenti MHA nei bambini è efficace quanto l'uso a lungo termine (7 giorni) di MGCA deboli.
effetti collaterali, che è dimostrato da dati provenienti da studi randomizzati e controllati, ma è accompagnato da una significativa diminuzione dell'efficacia terapeutica degli MGC locali.
Con una significativa diminuzione dell'intensità delle manifestazioni cliniche della malattia, si raccomanda una riduzione graduale della frequenza e della frequenza di applicazione dell'MHA. L'uso di farmaci combinati locali di corticosteroidi e antibiotici non presenta vantaggi rispetto all'MGCA (in assenza di complicanze infettive).
Il rischio di sviluppare effetti collaterali locali della terapia con MGC (strie, atrofia cutanea, teleangectasia), soprattutto in aree sensibili della pelle (viso, collo, pieghe), limita la possibilità di uso a lungo termine di MGC locali per l'AD.
L'uso dell'MHA locale sulle aree cutanee sensibili è limitato.
A seconda della capacità dell'MHA di legarsi ai recettori citosolici, bloccare l'attività della fosfolipasi A2 e ridurre la formazione di mediatori dell'infiammazione, tenendo conto della concentrazione del principio attivo
I corticosteroidi vengono assorbiti meglio nelle aree infiammate e desquamate rispetto alla pelle normale e penetrano molto più facilmente attraverso il sottile strato corneo nei neonati che attraverso la pelle dei bambini adolescenti. Inoltre, le aree anatomiche con epidermide sottile sono significativamente più permeabili alle MGC.
Le differenze anatomiche nell'assorbimento (come percentuale della dose totale assorbita dall'intera superficie corporea) sono le seguenti:
Superficie plantare del piede - 0,14%;
Superficie palmare - 0,83%;
Avambraccio - 1,0%;
Cuoio capelluto - 3,5%;
Area della mascella inferiore - 13%;
La superficie dei genitali è del 42%.
Altri fattori che influenzano l’azione dell’MHA:
Un aumento della concentrazione di un MHA specifico, a seconda della forma del farmaco, aumenta l'effetto terapeutico.
Le medicazioni occlusive aiutano a idratare la pelle e aumentano significativamente l'assorbimento e l'attività dell'MHA (fino a 100 volte).
la base dell'unguento del farmaco di solito migliora l'assorbimento del principio attivo e quindi ha un effetto più potente rispetto a creme e lozioni.
In base alla forza d'azione, gli MGC sono solitamente suddivisi in classi di attività(in Europa esistono le classi I–IV, negli USA – classi I–VII; Tabelle 6, 7; Appendice 1):
- molto forte (classe IV);
- forte (classe III);
- medio (classe II);
Debole (classe I).
Tabella 6.
Classificazione degli MGC per grado di attività (Miller & Munro, 1980, con integrazioni)
Classe (laurea |
Nome comune internazionale |
attività) |
|
IV (molto forte) |
|
III (forte) |
Betametasone (betametasone valerato, betametasone dipropionato, codice ATC D07AC01) |
0,1% crema e unguento; Crema e unguento 0,05%. |
|
crema, emulsione, soluzione |
|
Metilprednisolone aceponato |
|
emulsione |
|
Triamcinolone acetonide(codice ATC D07AB09) unguento allo 0,1%, |
|
Fluocinolone acetonide |
|
Fluticasone (fluticasone propionato, codice ATC D07AC17) 0,005% unguento e 0,05% crema |
|
II (forza media) |
|
Io (debole) |
|
Tabella 7. |
|
Classificazione delle MGC per grado di attività (S. Jacob, T. Stieele) |
|
Classe (laurea |
Nome del farmaco |
attività) |
|
Io (molto forte) |
Clobetasol (codice ATC D07AD01) 0,05% crema, unguento |
Betametasone (betametasone dipropionato, codice ATC D07AC01) crema e unguento 0,1%; |
|
Crema e unguento 0,05%. |
|
II (forte) |
Mometasone (mometasone furoato, codice ATC D07AC13) 0,1% unguento, crema, soluzione |
Triamcinolone acetonide(codice ATC D07AB09) unguento allo 0,1%. |
|
III (forte) |
Betametasone (betametasone valerato, codice ATC D07AC01) crema e unguento 0,1% |
Fluticasone (fluticasone propionato, codice ATC D07AC17) 0,005% unguento e crema 0,05% |
|
IV (forza media) |
Fluocinolone acetonide(codice ATC D07AC04) 0,025% unguento, crema, gel, linimento |
Mometasone (mometasone furoato, codice ATC D07AC13) 0,1% unguento, crema, soluzione |
|
Triamcinolone acetonide(codice ATC D07AB09) unguento 0,025%. |
|
Metilprednisolone aceponato(codice ATC D07AC14) 0,1% unguento grasso, unguento, crema, |
|
emulsione |
|
V (forza media) |
Betametasone (betametasone valerato, codice ATC D07AC01) crema 0,1% |
Idrocortisone (idrocortisone butirrato, codice ATC D07BB04, D07AB02) 0,1% unguento, |
|
crema, emulsione, soluzione |
|
Fluocinolone acetonide(codice ATC D07AC04) 0,025% crema, gel, linimento |
|
VI (forza media) |
Alclometasone (alclometasone dipropionato, codice ATC D07AB10) 0,05% unguento, crema |
VII (debole) |
Idrocortisone (Idrocortisone acetato, codice ATC D07AA02) 0,5%, unguento 1% |
Prednisolone (codice ATC D07AA03) unguento allo 0,5%. |
In caso di riacutizzazioni gravi e localizzazione di lesioni cutanee patologiche sul tronco e sulle estremità, il trattamento inizia con MGC di classe III (di seguito viene utilizzata la classificazione di Miller & Munro, 1980); per il trattamento della pelle del viso e di altre aree sensibili della pelle (collo, pieghe), si consiglia l'uso di inibitori topici della calcineurina o MGC di I classe.
Per l'uso di routine quando si localizzano lesioni sul tronco e sulle estremità nei bambini, si raccomandano gli MGC di classe I o II.
L'MHC di classe IV non deve essere utilizzato nei bambini di età inferiore a 14 anni.
Durata dell'uso di MHA
La seguente disposizione può servire come raccomandazione di base per la durata di utilizzo delle MGC: la durata di utilizzo delle MGC dovrebbe essere ridotta al minimo per quanto consentito dalla situazione clinica. Un ciclo continuo di terapia con MGC nei bambini non deve superare le 2 settimane. Se il decorso cronico persistente dell'AD richiede un trattamento più lungo, è necessario ricorrere a cicli intermittenti (ad esempio, una pausa di due settimane dopo 2 settimane di terapia) o dare la preferenza agli inibitori topici della calcineurina.
MHA con proprietà antibatteriche e antifungine
Gli agenti antibatterici e antifungini topici sono efficaci nei pazienti con AD complicata da infezione cutanea batterica o fungina. Per evitare la diffusione di infezioni fungine durante la terapia antibiotica, è giustificato prescrivere farmaci complessi contenenti sia componenti batteriostatici che fungicidi (ad esempio betametasone dipropionato + gentamicina + clotrimazolo, codice ATX D07XC01; natamicina + neomicina + idrocortisone, codice ATX D07CA01) ( Appendice 1). Ci sono i seguenti argomenti a favore dell’uso di farmaci combinati nel trattamento dell’AD complicato da infezione secondaria:
la possibilità di un trattamento efficace delle dermatosi allergiche complicate da infezione, dove l'uso di farmaci monocomponenti è indesiderabile; maggiore aderenza del paziente al trattamento grazie a un regime semplificato (meno numero di farmaci utilizzati contemporaneamente);
per la dermatite atopica - la possibilità di superare la resistenza al GCS causata dai superantigeni di S. aureus;
ridurre il rischio di esacerbazione del processo all'inizio del trattamento, quando un gran numero di metaboliti che provocano l'infiammazione vengono rilasciati da microrganismi che muoiono sotto l'influenza di un farmaco antimicrobico;
per alcuni farmaci: aumento della durata d'azione dovuto all'effetto vasocostrittore del GCS (l'agente antimicrobico rimane più a lungo nella lesione, viene assorbito e metabolizzato più lentamente).
Va notato che l'uso di steroidi fluorurati potenti, che includono betametasone dipropionato, nella pratica pediatrica è indesiderabile a causa dell'alto rischio di sviluppare reazioni avverse ai farmaci correlate agli steroidi. In particolare, negli Stati Uniti, un farmaco a due componenti contenente betametasone dipropionato e clotrimazolo è approvato per l'uso a partire dai 17 anni, mentre i farmaci monocomponenti a base di betametasone dipropionato sono limitati a 12 anni. A questo proposito, quando si trattano lesioni infette nei bambini, soprattutto quando sono localizzate su aree sensibili della pelle, è preferibile utilizzare farmaci combinati contenenti un corticosteroide debole - idrocortisone.
Inibitori della calcineurina (CI)
Gli inibitori topici della calcineurina (immunomodulatori topici) includono pimecrolimus (codice ATX: D11AH02) crema all'1% e tacrolimus (codice ATX: D11AH01) 0,03% e unguento allo 0,1%.
Pimecrolimus è utilizzato nel trattamento topico dell'AD lieve e moderato nei bambini di età superiore a 3 mesi. Tacrolimus è usato come unguento allo 0,03% nei bambini di età superiore ai 2 anni e come unguento allo 0,1% (o unguento allo 0,03%) nei pazienti di età superiore ai 16 anni. L'attività antinfiammatoria del tacrolimus corrisponde all'attività MHA di classe III e del pimecrolimus all'attività MHA di classe I, e pertanto pimecrolimus è indicato per il trattamento delle forme lievi e moderate di AD e tacrolimus - per le forme moderate e gravi.
Tacrolimus e pimecrolimus hanno un basso assorbimento sistemico; a differenza degli MHA, non provocano atrofia cutanea e non influenzano la funzionalità del sistema ipotalamo-ipofisi-surrene. I farmaci possono essere utilizzati in combinazione con MHA. Dopo che i sintomi di una grave esacerbazione si sono ridotti, l'MHA viene sostituito con un inibitore della calcineurina, che evita lo sviluppo di sindrome da astinenza, atrofia cutanea e acne steroidea, soprattutto sul viso. Gli inibitori della calcineurina hanno un effetto fungistatico contro la maggior parte dei ceppi di Malassezia spp.
Il tacrolimus è un farmaco approvato per il trattamento di mantenimento a lungo termine dell'AD (moderato e grave) su base bisettimanale per 12 mesi.
E di più nei pazienti con frequenti riacutizzazioni (più di 4 episodi all'anno) per prevenire nuove riacutizzazioni e prolungare il periodo di remissione. Questa terapia è indicata solo per quei pazienti che hanno precedentemente risposto al trattamento con tacrolimus due volte al giorno per non più di 6 settimane (vale a dire, il trattamento ha portato alla risoluzione completa o quasi completa della malattia cutanea). Uso dell'unguento al tacrolimus per il mantenimento
La terapia secondo un regime di 2 volte a settimana consente di prolungare il periodo di remissione dell'AD di 6 volte rispetto al trattamento delle riacutizzazioni solo nei bambini e fino a 9 volte negli adulti. Dopo 12 mesi di terapia di mantenimento è necessario valutare la dinamica delle manifestazioni cliniche negli adulti
E decidere sull'opportunità di continuare l'uso profilattico di tacrolimus.
Dato il meccanismo d’azione, non si può escludere la possibilità di immunosoppressione locale, tuttavia, i pazienti che assumono tacrolimus o pimecrolimus hanno un rischio inferiore di sviluppare infezioni cutanee secondarie rispetto ai pazienti che ricevono MGC. Si consiglia ai pazienti che utilizzano inibitori topici della calcineurina di evitare l'esposizione solare attiva e di utilizzare la protezione solare.
I bloccanti della calcineurina possono essere applicati su aree della pelle dove l'uso a lungo termine di farmaci glucocorticosteroidi è indesiderabile.
Non è raccomandato l’uso di bloccanti topici della calcineurina per infezioni batteriche e/o virali. Durante il trattamento con bloccanti della calcineurina si deve evitare l'irradiazione artificiale o eccessiva dei raggi ultravioletti naturali della pelle.
Gli inibitori topici della calneurina non devono essere prescritti a pazienti con immunodeficienze congenite o acquisite o a pazienti che assumono farmaci immunosoppressori. Emollienti e idratanti possono essere utilizzati immediatamente dopo l'applicazione del pimecrolimus. Dopo l'applicazione di tacrolimus, non è consigliabile utilizzare emollienti e idratanti per 2 ore dopo l'applicazione, poiché ciò riduce l'efficacia del trattamento con tacrolimus. Nonostante il fatto che l'effetto clinico dei bloccanti topici della calcineurina si sviluppi più lentamente rispetto all'uso dei glucocorticosteroidi topici, questi gruppi di farmaci sono paragonabili nell'azione antinfiammatoria: ad esempio, l'efficacia del tacrolimus è simile ai glucocorticosteroidi potenti e il pimecrolimus è simili ai glucocorticosteroidi deboli.
I farmaci bloccanti della calcineurina vengono applicati in uno strato sottile sulla superficie interessata 2 volte al giorno. Il trattamento dovrebbe iniziare alle prime manifestazioni della malattia e continuare fino alla completa scomparsa dei sintomi. Dato il bassissimo assorbimento sistemico degli inibitori della calcineurina, non esistono restrizioni sulla dose giornaliera totale del farmaco applicato, sull’area della superficie cutanea trattata e sulla durata del trattamento. I farmaci possono essere applicati su qualsiasi area della pelle, compresa la testa, il viso, il collo, le pieghe della pelle, nonché l'area periorbitale e le palpebre, dove l'uso di MHA è controindicato a causa del rischio di complicanze oftalmologiche.
Non applicare farmaci sulle mucose o sotto medicazioni occlusive. Le reazioni avverse più comuni durante il trattamento con bloccanti della calcineurina
sono sintomi di irritazione cutanea (sensazione di bruciore e prurito, arrossamento) nei siti di applicazione. Questi fenomeni sono associati al rilascio della sostanza P dalle terminazioni nervose, continuano durante i primi 5-20 minuti dopo l'applicazione del farmaco e tendono a scomparire dopo alcuni giorni di terapia.
Nei pazienti adolescenti con AD da moderata a grave, sono possibili tattiche terapia proattiva- utilizzando MGC (principalmente di media intensità) e IR. Una singola applicazione viene utilizzata in due giorni consecutivi della settimana per 4 mesi.
Preparati a base di catrame, naftalano, ittiolo, dermatolo
Di attività inferiore ai moderni farmaci non steroidei per il trattamento dell'AD, sono attualmente utilizzati meno frequentemente, tuttavia in alcuni casi possono servire come alternativa agli MGC e agli inibitori della calcineurina. Anche il lento sviluppo del loro effetto antinfiammatorio e il pronunciato difetto estetico ne limitano l’uso diffuso.
Dovrebbero essere presi in considerazione i dati sul possibile rischio di effetto cancerogeno dei derivati del catrame, che si basano su studi sulle malattie professionali nelle persone che lavorano con componenti del catrame.
Zinco piritione attivato
Lo zinco piritione attivato (0,2% aerosol, 0,2% crema e 1% shampoo) è un farmaco non steroideo con un'ampia gamma di effetti farmacologici. Il suo utilizzo riduce il numero di vasi dilatati, la densità perivascolare
Il significato degli indici PASI e SCORAD nella valutazione oggettiva delle dermatosi socialmente significative PASI. Lo Psoriasis Area and Severity Index (PASI) è lo strumento più comunemente utilizzato per misurare la gravità e l’attività del processo psoriasico. I criteri per il calcolo dell'indice furono proposti per la prima volta nel 1979 e sono rimasti sostanzialmente invariati fino ad oggi. L'utilizzo del PASI non ha solo un aspetto scientifico, ma anche e soprattutto un carattere applicativo. Con il suo aiuto determinano le tattiche e la strategia per la gestione dei pazienti affetti da psoriasi e, naturalmente, l’efficacia (adeguatezza) della loro terapia. Il PASI combina valutazioni quantitative della gravità delle principali manifestazioni cliniche (infiltrazioni, prurito, ispessimento cutaneo, edema, iperemia, desquamazione) con una valutazione dell'area interessata su una scala lineare semplice. I valori PASI da 0 (nessuna manifestazione cutanea della malattia) a 10 punti sono considerati un decorso lieve della malattia; fino a 20-30 punti di gravità media del processo; da 30 a 72 punti (le manifestazioni cutanee più pronunciate) psoriasi grave. Di seguito forniamo una versione tabellare dettagliata del calcolo dell'indice PASI (Tabella 1). Tabella 1 Calcolo dell'indice PASI Il PASI (Psoriasis Area and Severity Index) è lo strumento principale per determinare la gravità della psoriasi. L'utilizzo dell'indice consente di valutare oggettivamente l'efficacia della terapia e idealmente dovrebbe essere calcolato prima, durante e dopo la fine del ciclo di terapia. L'indice PASI è rappresentato come un numero intero da 0 (nessuna malattia) a 72 (il decorso più grave) e riflette l'area della lesione, tenendo conto dell'intensità dei segni clinici come eritema, intensità della desquamazione e infiltrazione. Esistono diverse modifiche per il calcolo dell'indice PASI, tuttavia, secondo la maggior parte degli autori, la scala, che tiene conto dei tre segni clinici sopra indicati, è considerata classica. Testa Arti superiori Area danni: Area danni: 0%<10% 10-29% 30-49% 50-69% 70-89% >89% 0% <10% 10-29% 30-49% 50-69% 70-89% >89% Eritema 0 1 2 3 4 Eritema 0 1 2 3 4 Infiltrazione 0 1 2 3 4 Infiltrazione 0 1 2 3 4
Peeling 0 1 2 3 4 Peeling 0 1 2 3 4 Tronco Arti inferiori Area lesione: Area lesione: 0%<10% 10-29% 30-49% 50-69% 70-89% >89% 0% <10% 10-29% 30-49% 50-69% 70-89% >89% Eritema 0 1 2 3 4 Eritema 0 1 2 3 4 Infiltrazione 0 1 2 3 4 Infiltrazione 0 1 2 3 4 Peeling 0 1 2 3 4 Peeling 0 1 2 3 4 Area Eritema Peeling Infiltrazione Area della lesione Coefficiente di peso Testa 0,1 Braccia 0,2 Torso 0,3 Gambe 0,4 Conteggio PASI totale. Per determinare l'indice PASI, il corpo del paziente viene suddiviso condizionatamente in quattro aree (gambe 40% della superficie totale della pelle umana, busto (torace, addome, schiena) 30% della superficie cutanea, braccia 20% e testa 10%). A ciascuna di queste quattro aree viene assegnato un punteggio separato da 0 a 6 punti a seconda del grado di danno. Successivamente, per ciascuna zona, viene valutata l'intensità di ciascuno dei tre segni clinici di eritema, intensità di desquamazione e infiltrazione. L'intensità è valutata da 0 (assenza di segno) a 4 (massimo grado di manifestazione). Successivamente, per ciascuna zona, si determina il suo indice utilizzando la formula: (eritema + desquamazione + infiltrazione) x grado di danno x coefficiente di peso della zona. Il coefficiente di ponderazione della regione corrisponde alla superficie della pelle: 0,4 gambe, 0,3 busto, 0,2 braccia, 0,1 testa. Dopo aver calcolato l'indice per ciascuna delle quattro aree, si sommano gli indicatori risultanti e si ottiene l'indice PASI complessivo complessivo. PASI Le raccomandazioni terapeutiche più autorevoli per la scelta della terapia razionale nei pazienti affetti da psoriasi sono attualmente basate sulla valutazione quantitativa del PASI. Come risultato di numerosi studi a lungo termine con una base di prove indiscutibile, è stata proposta una scala che determina la strategia terapeutica (uso di farmaci correlati alla terapia generale) per la gestione di pazienti con varie manifestazioni di psoriasi, che viene presentata di seguito, in una versione testuale nella Tabella 2. Tabella 2 Tattiche terapeutiche di gestione dei pazienti con psoriasi in base al valore del PASI calcolato
Intervento richiesto PASI >60% Intervento consigliato PASI 30-60% Intervento sconsigliato PASI<30% Необходимо отметить, что предложенные принципы актуальны, главным образом, для терапии индукции, так как положительные результаты снижения индекса PASI обычно учитываются в исследованиях спустя 12-16 недель от старта терапии, поэтому руководствоваться представленными выше рекомендациями в стационарной стадии болезни не следует. Основная проблема PASI связана с трудностями использования индекса в рутинной клинической практике, вне клинических испытаний лекарственных средств и методов лечения. Это неоднократно приводило к многочисленным попыткам упростить шкалу PASI, чтобы сделать её более пригодной с практической точки зрения, а также для самостоятельного отслеживания больными изменений в своём локальном статусе. Вопрос рационального упрощения PASI, без заметного изменения результатов эффективности его использования остается злободневным по настоящий момент. Опытным путем, в результате проведения многократных клинических испытаний, была установлена необходимая количественная мера снижения PASI для положительной оценки влияния на течение псориаза того или иного медицинского вмешательства. Особенную, важную роль при этом сыграли испытания по эффективности биологических препаратов, в результате которых было окончательно установлено, что эффективной медицинская интервенция считается только тогда, когда она приводит к снижению PASI не менее, чем на 75% по отношению к базовому показателю за определенный временной промежуток. В некоторых аналитических публикациях PASI в этой связи обозначают как PASI 75, не расшифровывая значение данной аббревиатуры. Есть и другая система оценки эффективности проводимой терапии при псориазе, когда снижение индекса PASI на фоне лечения от исходного на 25% расценивается как неэффективное, от 25 до 49% незначительное улучшение, от 50 до 74% улучшение, более 75% значительное улучшение. SCORAD. С 1990 г. по 1993 г. Европейской международной группой экспертов из 9 стран разрабатывалась система оценки проявлений и тяжести АД. Результатом этой работы явилась публикация обобщающего согласительного документа Severity Scoring of Atopic Dermatitis (дословный перевод с английского «шкалирование тяжести атопического дерматита») с разработкой и обоснованием внедрения в клиническую практику «The
Indice SCORAD". L'esperienza ha dimostrato l'elevata efficacia del metodo SCORAD grazie alla sua informatività, obiettività, semplicità e accessibilità d'uso da parte dei medici, indipendentemente dalla loro esperienza lavorativa e persino dalla specializzazione. La metodologia per valutare le manifestazioni e la gravità dell'AD utilizzando l'indice SCORAD comprende una valutazione completa di tre blocchi di informazioni: la prevalenza delle lesioni cutanee (A), la loro gravità o intensità (B) e i sintomi soggettivi (C). A. Per valutare l'entità della lesione in base al pattern anteroposteriore su una scala da 0 a 100, utilizzare la regola del nove, dove l'area della superficie palmare della mano è presa come una (Figura 1). Figura 1 che valuta l'estensione della lesione in base al modello anteroposteriore su una scala da 0 a 100 Bambini sotto i 2 anni di età Bambini sopra i 2 anni di età Le figure mostrano numeri corrispondenti all'una o all'altra parte della superficie cutanea. Ad esempio, se è completamente interessata la superficie anteriore di un arto inferiore, il punteggio sarà 9, se è interessata l'intera superficie del torace e dell'addome, 18, ecc. Le lesioni cutanee totali sono rare, pertanto, quando si valuta l'area delle lesioni, è necessario utilizzare la regola del “palmo” (“nove”) sopra menzionata. Per fare ciò, il medico esamina completamente la pelle del paziente e disegna i contorni delle aree interessate su un'immagine con stencil. Quindi a ciascuna zona viene assegnato un punteggio e li somma: la somma dei punti sulla superficie anteriore + la somma dei punti sulla superficie posteriore. L'importo totale viene arrotondato ai 5 punti più vicini. Il punteggio totale può variare da 0 punti (nessuna lesione cutanea) a 96 (per bambini sotto i 2 anni di età) e 100 punti (per bambini sopra i 2 anni di età e adulti) per il danno cutaneo totale (massimo).
B. L'intensità delle manifestazioni cliniche dell'AD (sintomi oggettivi) è valutata da sei sintomi: eritema, gonfiore/papula, formazione di croste/bagnamento, escoriazione, lichenificazione, pelle secca. Ad ogni segno viene assegnato un punteggio da 0 a 3 punti (0 assente, 1 lieve, 2 moderato, 3 grave) in base alle fotografie consigliate. Non sono ammessi mezzi voti. I punteggi vengono forniti in un'apposita tabella dei punteggi, quindi l'indice SCORAD complessivo viene calcolato utilizzando la formula seguente. L'area selezionata per la valutazione dovrebbe rappresentare, con intensità media, ciascun sintomo in un dato paziente, escludendo quindi l'area target o l'area di maggiore coinvolgimento. Tuttavia, la stessa area può essere selezionata per 2 o più funzioni. Ad esempio, la stessa area può essere utilizzata per valutare sia l'escoriazione che l'eritema. D'altra parte, la secchezza può esprimersi in aree che non presentano eruzioni acute o lichenificazione. Valutazione dei segni. Eritema o arrossamento (Figure 2-4). Figura 2. Figura 3. Figura 4. Determinare questo segno sulla pelle chiara non è un problema. Se il punteggio non è possibile, ciò deve essere indicato nelle note a piè di pagina della tabella dei punteggi. Edema, formazione di papule (Figure 5-7). Figura 5. Figura 6. Figura 7. Per edema/papula si intende un'infiltrazione palpabile della pelle, che può verificarsi sia nell'eritematosi acuta, nelle aree di escoriazione, sia nelle eruzioni cutanee croniche durante una riacutizzazione. Questo segno è difficile da identificare dalle fotografie cliniche. Ecco perché
la palpazione della lesione dovrebbe essere presa in considerazione quando si valuta questo segno. Piante/croste (Figure 8-10). Figura 8. Figura 9. Figura 10. Questo segno si applica alle lesioni essudative risultanti da edema e vescicole. L'aspetto quantitativo dell'essudato può essere determinato mediante esame clinico e colloqui con i genitori, nonché dai livelli di albumina sierica in assenza di altra patologia. Escoriazioni (Figure 11-13). Figura 11. Figura 12. Figura 13. Questo segno stesso è un indicatore oggettivo di prurito, più evidente nelle lesioni non lichenificate. Il numero e l'intensità dei graffi per ciascun punteggio sono illustrati sopra. Lichenificazione (Figure 14-16). Figura 14. Figura 15. Figura 16. Questo segno è simile all'ispessimento epidermico nelle lesioni croniche. Le pieghe della pelle fortemente definite sono separate da lucide
aree a forma di diamante, colore grigio-brunastro. I focolai pruriginosi e le grandi lesioni delle pieghe sono suscettibili alla lichenificazione, che si osserva più spesso nei pazienti di età superiore ai 2 anni. Secchezza. Quando possibile, questo segno dovrebbe essere valutato in aree lontane dai focolai di infiammazione e senza preventiva applicazione di emollienti o idratanti, anche su una scala a 3 punti. Le squame delle lesioni infiammatorie guarite non dovrebbero essere prese in considerazione. La palpazione è importante anche per valutare la ruvidità della pelle. È obbligatorio indicare se è presente una concomitante ittiosi vulgaris (sotto le note principali della scheda di valutazione). La presenza di screpolature è solitamente associata a grave secchezza delle estremità. C. Sintomi soggettivi di prurito e disturbi del sonno associati a lesioni cutanee e prurito. Questi segni vengono valutati nei bambini di età superiore a 7 anni, a condizione che i genitori comprendano il principio di valutazione. L’errore più comune è quello di registrare “disturbi del sonno” per vari motivi non legati alla pressione arteriosa. Al paziente o ai suoi genitori viene chiesto di indicare un punto all'interno di un righello di 10 centimetri corrispondente alla gravità del prurito e dei disturbi del sonno mediati negli ultimi 3 giorni. Ad ogni sintomo soggettivo viene assegnato un punteggio compreso tra 0 e 10 punti; i punti sono riassunti. Il punteggio totale dei sintomi soggettivi può variare da 0 a 20. L'ultima fase è il calcolo diretto del valore dell'indice SCORAD. Per fare ciò è necessario inserire tutti i punti ricevuti sulla scheda di valutazione. L'indice SCORAD si calcola utilizzando la formula: SCORAD=A/5+7*B/2+C, dove A è l'area della pelle interessata, in%; B punteggio totale dei segni oggettivi (eritema, edema, stillicidio, escoriazioni, lichenificazione, secchezza); C è la somma dei punteggi dei sintomi soggettivi (prurito, perdita del sonno). Esempio di calcolo. Il paziente P., 12 anni, è stato ricoverato in clinica con una diagnosi di neurodermite diffusa, stadio acuto. L'area del danno alla pelle è del 65%. Valutazione dei sintomi oggettivi: eritema 2 punti, gonfiore e papule 2 punti, essudazione 2 punti, escoriazioni 3 punti, lichenificazione 2 punti, secchezza 2 punti. Totale: il punteggio di intensità totale dei sintomi oggettivi è di 13 punti. Valutazione dei sintomi soggettivi: prurito 8 punti, grado di disturbo del sonno 7 punti. Totale: il punteggio totale dei sintomi soggettivi è di 15 punti. L'indice SCORAD è 65/5 + 7*13/2 + 15 = 73,5 punti.
Per valutare oggettivamente l’efficacia della terapia, l’indice SCORAD dovrebbe essere calcolato prima e dopo il trattamento.
(Punteggio di gravità della dermatite atopica: l’indice SCORAD)Versione funzionante adattata
Voglio ricevere un libro di testo sul sistema SCORAD!
(Non voglio leggere questo articolo)
Per valutare la gravità della dermatite atopica (AD) e l'esame della disabilità, è importante determinare la forma clinica dell'AD, l'area del danno, l'intensità del prurito e il grado di disturbo del sonno. A questo proposito, il sistema di punteggio per la gravità dell'AD - SCORAD (punteggio della dermatite atopica - scala della dermatite atopica), sviluppato da un gruppo di scienziati provenienti da paesi europei, merita attenzione, studio e implementazione.
Fase IDeterminazione e valutazione dei segni di intensità (sintomi oggettivi)
Il sistema SCORAD identifica 6 segni: 1) eritema (iperemia), 2) edema/papulogenesi, 3) essudazione/croste, 4) escoriazione, 5) lichenificazione, 6) secchezza.
Ad ogni segno viene assegnato un punteggio da 0 a 3 punti (0 - assente, 1 - lieve, 2 - moderato, 3 - grave) in base alle fotografie consigliate. Non sono ammessi mezzi voti. I punteggi vengono forniti in un'apposita tabella dei punteggi, quindi l'indice SCORAD complessivo viene calcolato utilizzando la formula seguente.
L'area selezionata per la valutazione dovrebbe rappresentare, con intensità media, ciascun sintomo in un dato paziente, escludendo quindi l'area target o l'area di maggiore coinvolgimento. Tuttavia, la stessa area può essere selezionata per 2 o più funzioni. Ad esempio, la stessa area può essere utilizzata per valutare sia l'escoriazione che l'eritema. D'altra parte, la secchezza può esprimersi in aree che non presentano eruzioni acute o lichenificazione.
Valutazione delle caratteristiche:
Eritema o arrossamento
(Fig. 1-3). Determinare questo segno sulla pelle chiara non è un problema. Se il punteggio non è possibile, indicarlo nelle note a piè di pagina della tabella dei punteggi.Edema, formazione di papule
(Fig. 4-6). Per edema/papulogenesi si intende un'infiltrazione palpabile della pelle, che può verificarsi sia nell'eritematosi acuta, nelle aree di escoriazione, sia nelle eruzioni cutanee croniche durante una riacutizzazione. Questo segno è difficile da determinare dalle fotografie cliniche. Pertanto, la palpazione della lesione dovrebbe essere presa in considerazione quando si valuta questo segno.Piangente/crosta (Fig. 7-9). Questo segno si applica alle lesioni essudative derivanti da edema e vescicole. L'aspetto quantitativo dell'essudato può essere determinato mediante esame clinico e colloqui con i genitori, nonché dai livelli di albumina sierica in assenza di altra patologia.
Escoriazione (Fig. 10-12). Questo segno stesso è un indicatore oggettivo di prurito, più evidente nelle lesioni non lichenificate. Vengono illustrati il numero e l'intensità dei graffi per ciascun punteggio.
Lichenificazione (Fig. 13-15). Questo segno è simile all'ispessimento epidermico nelle lesioni croniche. Le pieghe della pelle fortemente pronunciate sono separate da aree lucide a forma di diamante, il colore è grigio-brunastro. I focolai pruriginosi e le grandi lesioni piegate sono suscettibili alla lichenificazione, che si osserva più spesso nei pazienti di età superiore ai 2 anni.
Secchezza. Quando possibile, questo segno dovrebbe essere valutato in aree lontane dai focolai di infiammazione e senza preventiva applicazione di emollienti o idratanti, anche su una scala a 3 punti. Le squame delle lesioni infiammatorie guarite non dovrebbero essere prese in considerazione. La palpazione è importante anche per valutare la ruvidità della pelle. È obbligatorio indicare se è presente una concomitante ittiosi vulgaris (sotto le note principali della scheda di valutazione). La presenza di screpolature è solitamente associata a grave secchezza delle estremità.
Fase II.
Calcolo dell'area delle lesioni cutanee
L'area della lesione viene valutata nei bambini secondo la regola del nove ed è raffigurata in dettaglio sul foglio di valutazione nei disegni dei contorni del corpo del bambino dalla parte anteriore e posteriore con aggiustamenti (relativi alla testa e alle estremità inferiori ) per pazienti di età inferiore a 2 anni (Fig. 16, 17). Le lesioni prese in considerazione dovrebbero presentare solo lesioni infiammatorie, ma non secchezza. Si prega di notare che un palmo del paziente costituisce l'1% dell'intera superficie cutanea.
Fase III.
Valutazione dei segni soggettivi
Questi includono prurito e disturbi del sonno. Il paziente (di solito di età superiore ai 7 anni) o i suoi genitori devono rispondere in modo completo e corretto alle vostre domande su questo argomento. Chiedere al paziente (o ai suoi genitori) di indicare sulla scala di 10 cm del modulo di valutazione il punto corrispondente al valore medio degli ultimi 3 giorni/notti. L'intensità del prurito e il grado di disturbo del sonno vengono valutati su una scala a 10 punti (da 0 a 10).
Fase IV
Calcolo del valore dell'indice SCORAD
Inserisci tutti i punti ricevuti sul referto. L’indice SCORAD si calcola utilizzando la formula:
SCORAD=A/5+7*B/2+C, Dove
A - area della pelle interessata, in%;
B - somma di punti di segni oggettivi (eritema, edema, trasudamento, escoriazioni, lichenificazione, secchezza);
C è la somma dei punteggi dei segni soggettivi (prurito, perdita del sonno).
Esempio di calcolo.Il paziente P., 12 anni, è stato ricoverato in clinica con una diagnosi di neurodermite diffusa, stadio acuto. L'area del danno alla pelle è del 65%. Valutazione dei sintomi oggettivi: eritema - 2 punti, gonfiore e formazione di papule - 2 punti, essudazione - 2 punti, escoriazioni - 3 punti, lichenificazione - 2 punti, secchezza - 2 punti. Totale: il punteggio di intensità totale dei sintomi oggettivi è di 13 punti.
Valutazione dei sintomi soggettivi: prurito - 8 punti, grado di disturbo del sonno - 7 punti. Totale: il punteggio totale dei sintomi soggettivi è di 15 punti.
L'indice SCORAD è 65/5 + 7*13/2 + 15 = 73,5 punti.
Nota.L'indice SCORAD dovrebbe essere calcolato prima e dopo il trattamento per valutare oggettivamente l'efficacia della terapia.
Letteratura
1. Punteggio di gravità della dermatite atopica: l'indice SCORAD. Rapporto di consenso della Task Force europea sulla dermatite atopica // Dermatologia.-1993; 186(1): 23-31.
2. Toropova N.P., Sinyavskaya O.A., Gradinarov A.M. // Russian Medical Journal.-1997.-#11.
Numeri di pagina del problema: 33-34
Dermatite atopica: diagnostica di base e ruolo dei cosmetici medicinali nella terapia
Per preventivo: Dermatite atopica: basi della diagnosi e ruolo dei cosmetici medicinali nella terapia. Consilium Medicum. Dermatologia (Add.). 2016; 4:33–34.Dermatite atopica: le basi della diagnosi e il ruolo dei cosmeceutici nel trattamento
Per citazione: Dermatite atopica: le basi della diagnosi e il ruolo dei cosmeceutici nel trattamento. Consilium Medicum. Dermatologia (Suppl.). 2016; 4:33–34. La dermatite atopica (AD) è un problema urgente in dermatologia. È una delle malattie cutanee croniche recidivanti più comuni al mondo. L'AD colpisce rappresentanti di tutte le razze e popoli, con la più alta prevalenza di questa malattia registrata nei paesi industrializzati.Secondo le statistiche ufficiali, in Russia l'AD è stata diagnosticata per la prima volta in 240-250 persone su 100mila della popolazione esaminata.
Definizione
Il termine AD definisce il concetto immunologico (allergico) di patogenesi della malattia, basato sul concetto di atopia come capacità geneticamente determinata dell'organismo di produrre alte concentrazioni di anticorpi immunoglobuline E (IgE) generali e specifici in risposta agli allergeni ambientali. Tuttavia, nello sviluppo dell’AD sono coinvolti non solo meccanismi specifici (immuni) ma anche non specifici (non immuni). Insieme determinano l'unicità della reazione della pelle all'azione dei fattori causali, espressa nelle caratteristiche della risposta immunitaria e dell'iperreattività.Forme dell'AD
Secondo la nomenclatura della European Respiratory Society, si distinguono due forme della malattia:estrinseco – associato alla sensibilizzazione agli allergeni esterni e caratterizzato da un aumento dei livelli di IgE;
intrinseca – non è possibile confermare la presenza di atopia, nonostante il quadro clinico tipico delle lesioni cutanee.
Quadro clinico
Prurito intenso e reattività cutanea, associati a una ridotta “soglia del prurito”, sono i principali segni dell’AD. Il processo patologico della pelle può essere di diversi tipi:eruzioni acute - eritematose-papulari o eritematose-vescicolari, escoriazioni multiple ed erosioni con essudato sieroso;
subacuto – eritema, escoriazioni e desquamazione;
cronico - ispessimento della pelle nelle zone colpite (lichenificazione) e papule fibrose.
Spesso, nei pazienti con processo cronico, è possibile osservare contemporaneamente tutti e tre i tipi di reazioni cutanee.
Criteri diagnostici minimi
 L'algoritmo diagnostico dell'AD, proposto da esperti americani nel 1999 e basato sui criteri Hanifin e Rajka, comprende criteri obbligatori e aggiuntivi. I criteri Hanifin e Rajka rimangono validi e sono abbastanza adatti per la diagnosi clinica di entrambe le forme di AD.
L'algoritmo diagnostico dell'AD, proposto da esperti americani nel 1999 e basato sui criteri Hanifin e Rajka, comprende criteri obbligatori e aggiuntivi. I criteri Hanifin e Rajka rimangono validi e sono abbastanza adatti per la diagnosi clinica di entrambe le forme di AD. Caratteristiche di base (obbligatori):
prurito;
morfologia e distribuzione tipica;
lichenificazione dei flessori (ispessimento della pelle);
danni alla pelle del viso e alle superfici estensori nei neonati e nei bambini piccoli;
decorso cronico ricorrente di dermatite;
storia familiare di atopia (asma, rinocongiuntivite allergica, AD).
Ulteriori caratteristiche spesso combinate con AD:
xerosi (pelle secca);
ittiosi (aumento del disegno della pelle palmare);
dermatiti delle mani e/o dei piedi;
cheilite;
eczema del capezzolo;
sensibilità (suscettibilità) alle infezioni della pelle (in particolare Staphylococcus aureus e Herpes simplex) e ad altre infezioni virali (verruche, mollusco contagioso), dermatofiti;
eritroderma;
esordio in tenera età;
immunità cellulare indebolita;
congiuntivite ricorrente concomitante;
piega infraorbitaria;
cheratocono;
cataratta sottocapsulare anteriore;
livelli sierici elevati di IgE;
Eosinofilia del sangue periferico.
Diagnosi di AD = 3 segni obbligatori + 3 segni aggiuntivi.
Diagnosi differenziale
Se sulla base di questi criteri non è possibile fare una diagnosi di AD, allora è necessario effettuare una diagnosi differenziale con le seguenti malattie:scabbia;
dermatite seborroica;
dermatite allergica da contatto;
linfoma cutaneo;
eczema nummulare;
dermatofiti;
malattie associate all'HIV;
Dermatite erpetiforme di Dühring;
cheratosi familiare;
malattia da trapianto;
sindrome da iper-IgE;
dermatomiosite.
Indice SCORAD
 Per valutare la gravità del processo cutaneo e la dinamica della malattia, la Società Europea di Dermatovenerologia (Ginevra, 1993) ha sviluppato e approvato il coefficiente SCORAD. Questo coefficiente comprende una valutazione globale di tre blocchi di informazioni: la prevalenza delle lesioni cutanee (A), la loro gravità o intensità (B) e i sintomi soggettivi (C).
Per valutare la gravità del processo cutaneo e la dinamica della malattia, la Società Europea di Dermatovenerologia (Ginevra, 1993) ha sviluppato e approvato il coefficiente SCORAD. Questo coefficiente comprende una valutazione globale di tre blocchi di informazioni: la prevalenza delle lesioni cutanee (A), la loro gravità o intensità (B) e i sintomi soggettivi (C). Per valutare l'entità della lesione in base al pattern anteroposteriore su una scala da 0 a 100, utilizzare la regola del nove, dove l'area della superficie palmare della mano è considerata come una (Guarda l'immagine).
L'intensità delle manifestazioni cliniche dell'AD (sintomi oggettivi) è valutata da 6 sintomi: eritema, gonfiore/papule, formazione di croste/bagnamento, escoriazione, lichenificazione, pelle secca. Ad ogni segno viene assegnato un punteggio da 0 a 3 (0 – assente, 1 – lieve, 2 – moderato, 3 – grave).
I sintomi soggettivi sono prurito e disturbi del sonno associati a lesioni cutanee e prurito. Questi segni vengono valutati nei bambini di età superiore a 7 anni, a condizione che i genitori comprendano il principio di valutazione. Ad ogni sintomo soggettivo viene assegnato un punteggio compreso tra 0 e 10 punti; i punti sono riassunti. I punteggi dei sintomi soggettivi possono variare da 0 a 20.
L’indice SCORAD si calcola utilizzando la formula:
SCORAD=A/5+7×B/2+C, dove A è l'area di pelle interessata (%), B è la somma dei punti dei segni oggettivi (eritema, edema, trasudamento, escoriazioni, lichenificazione, secchezza) , C è la somma dei punti dei segni soggettivi (prurito, perdita di sonno).
Ai fini della valutazione oggettiva dell'efficacia della terapia, calcolo dell'indiceSCORAD deve essere eseguito prima e dopo il trattamento.
Terapia dell'AD
Negli ultimi anni sono stati proposti molti nuovi farmaci e metodi per il trattamento dell’AD. Tuttavia, la terapia esterna occupa il posto principale nel complesso trattamento dell'AD. La scomparsa o la riduzione delle manifestazioni di AD sotto l'influenza della terapia esterna ha un effetto benefico sullo stato generale e psico-emotivo del paziente. Il trattamento esterno nella maggior parte dei casi inizia con l'uso di varie paste, unguenti e poltiglia indifferenti che contengono agenti antinfiammatori, cheratolitici e cheratoplastici. Nei casi in cui questo trattamento esterno è inefficace, così come nelle riacutizzazioni gravi, nelle forme torpide di AD, è necessario utilizzare glucocorticoidi topici a causa della loro significativa attività antinfiammatoria, antiallergica e antipruriginosa. Nella pratica pediatrica, quando si prescrive, viene data preferenza all'ultima generazione di glucocorticoidi non alogenati.Cosmetici medici
Una direzione promettente nel trattamento dell'AD e una componente importante delle misure volte a ridurre il numero di riacutizzazioni e ad aumentare la durata della remissione è un'adeguata cura della pelle, compresa la pulizia delicata, l'idratazione e l'ammorbidimento.Atoderm Intensive Balsamo (terapia intensiva)
Atoderm Intensive Balm elimina le disfunzioni biologiche che si verificano nella pelle atopica e le loro conseguenze. Può essere utilizzato contemporaneamente al trattamento dermatologico (inclusa la terapia locale con glucocorticoidi) durante i periodi di esacerbazione. Il complesso ristrutturante Lipigenium di acidi grassi idrata in profondità e ammorbidisce la pelle, accelera la rigenerazione cellulare e ripristina la barriera protettiva. Ceramide NP riduce la sensibilità della pelle, ripristina e rafforza le proprietà protettive dell'epidermide. La tecnologia Skin Barrier Therapy limita la proliferazione dello Staphylococcus aureus e la penetrazione degli allergeni. Il balsamo intensivo Atoderm elimina rapidamente prurito e tensione, lenisce la pelle, allevia arrossamenti e altri segni di irritazione.
Atoderm preventivo(cura preventiva)
Questa è l'unica crema che impedisce alla pelle secca di trasformarsi in pelle atopica fin dalla nascita.
Brevetto esclusivo Lipigennium è composto da acidi grassi essenziali rigeneranti (omega 3 e 6) e biolipidi (ceramidi) presenti nella pelle normale. Nel caso della pelle secca, si osserva la loro carenza. I biolipidi penetrano perfettamente nella pelle e ripristinano il film protettivo. Il brevetto terapeutico “Protezione naturale della pelle” impedisce l'adesione e la proliferazione di S. aureus, nonché la penetrazione di allergeni che provocano esacerbazioni del processo e secchezza. Texture ultra confortevole, profumazione leggera, ipoallergenica.