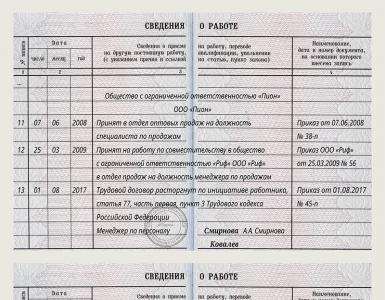
Danno alla valvola tricuspide causato da endocardite infettiva. Trattamento dell'endocardite infettiva. Cambiamenti di aspetto
L’endocardite infettiva è una malattia grave che colpisce il rivestimento interno delle camere del cuore (endocardio), le valvole e le corde tendinee. Nei siti di infezione si forma una massa amorfa costituita da piastrine e fibrina, che contengono molti microrganismi e una moderata quantità di batteri infiammatori. L'endocardite batterica delle strutture profonde del cuore è caratterizzata da una diagnosi difficile e da un decorso rapido, che in oltre il 50% dei casi termina con la morte.
Agenti causativi dell'endocardite infettiva
Un'infezione di qualsiasi origine può causare EI. Nell'endocardite infettiva, il quadro clinico è dominato da batteri del genere Staphylococcus, prevalentemente specie coagulasi-negative: epidermidis, saprophyticus, haemolyticus, hominis. Successivamente, in ordine decrescente, ci sono:
- specie emolitiche di streptococchi;
- streptococco di gruppo D - enterococco,
- batteri gram-negativi;
- gruppo di agenti patogeni NASEK (Haemophilus influenzae, Actinobacteria, Cardiobacteria, Eikenella, Kingella).
Secondo le statistiche mediche dell'OMS, i NASEK sono gli agenti causali dell'EI nel 4-8% dei casi. Va notato che anche con una ricerca approfondita della forma e del tipo del provocatore, nel 3-10% dei pazienti i risultati dell'emocoltura sono negativi.
Caratteristiche dei singoli agenti patogeni:
- Streptococchi viridanti. Sono abitanti permanenti del rinofaringe e diventano attivi in condizioni favorevoli. Ad esempio, con un aumento della temperatura corporea generale. Sono estremamente sensibili alla penicillina, quindi una combinazione efficace di penicillina e gentamicina viene utilizzata per distruggere gli streptococchi viridans.
- Streptococco bovis. Vivono nel tratto gastrointestinale e causano endocardite infettiva nel 20-40% dei casi diagnosticati di malattie cardiache. Spesso accompagna polipi e formazioni maligne nel retto, pertanto, per determinare il tipo di agente patogeno, viene prescritta una colonscopia se altri test danno un risultato negativo. Sono divisi in quattro gruppi: A, B, C e G. Più spesso di altri causano malattie primarie delle valvole cardiache sane.
- Streptococco pneumoniae. I batteri pneumococcici sono comuni. Sotto la sua influenza negativa, il tessuto sano del cuore viene destrutturato, causando ascessi miocardici estesi e multipli. Difficile da diagnosticare. Il quadro clinico delle complicanze e della prognosi è sfavorevole.
- Enterococchi. Fanno parte della normale flora del tratto gastrointestinale e causano malattie del tratto genito-urinario, responsabili del 5-15% dei casi di EI. La malattia ha la stessa frequenza negli uomini e nelle donne anziani (spesso il punto d'ingresso sono le vie urinarie) e nel 15% dei casi si associa ad infezione nosocomiale. Gli enterococchi infettano le valvole cardiache normali, patologicamente alterate e artificiali. L'esordio della malattia è acuto o subacuto. Il tasso di mortalità è paragonabile al tasso di mortalità per l’EI causata dallo streptococco viridans.
- Stafilococchi. Gli stafilococchi coagulasi positivi sono rappresentati da un'unica specie: S. aureus. Delle 13 specie di stafilococchi coagulasi-negativi che colonizzano gli esseri umani, S. aureus è emerso come un importante patogeno nel contesto dei dispositivi impiantati e delle infezioni iatrogene. Questo microrganismo è la principale causa di endocardite infettiva. L'EI causata da S. aureus è una malattia febbrile altamente tossica che colpisce il cuore, nel 30-50% dei casi si manifesta con complicazioni a carico del sistema nervoso centrale. Il liquido cerebrospinale di solito mostra leucocitosi neutrofila con un test colturale positivo per S. aureus.
- Stafilococchi coagulasi-negativi. I microrganismi, in particolare l'epidermide, sono una delle principali cause di EI, soprattutto durante il primo anno dopo l'intervento chirurgico su qualsiasi valvola cardiaca, e un'importante causa di EI acquisita in ospedale. L'endocardite, causata da stafilococco coagulasi-negativo, è spesso accompagnata da complicanze ed è fatale. Lo S. lugdunensis acquisito in comunità è associato a danni alla valvola cardiaca e alla necessità di un intervento chirurgico.
- Batteri Gram-negativi. Fanno parte della flora delle prime vie respiratorie e dell'orofaringe, infettano le valvole cardiache alterate, provocando la forma subacuta della malattia e sono la causa della patologia che si manifesta entro un anno dall'intervento chirurgico sulla valvola. Hanno esigenze particolari per il mezzo nutritivo e crescono lentamente; di solito vengono rilevati nel sangue dopo 5 giorni di incubazione. È stata stabilita una connessione tra batteri e vegetazioni massicce e un'elevata incidenza di embolia sistemica.
P. aeruginosa è un bastoncino Gram-negativo che causa l'endocardite. Le enterobatteriacee diventano agenti causali dell'endocardite batterica solo in casi isolati. La mortalità per EI causata da bacilli Gram-negativi è comune - 50%;
La Neisseria gonorrhoeae è oggi una rara causa di endocardite. Il microrganismo infetta l'AK nei pazienti giovani, causandone la distruzione e ascessi intracardiaci. N. gonorrhoeae è solitamente sensibile al ceftriaxone, ma in N. gonorrhoeae è ormai diffusa la resistenza agli antibiotici; pertanto, per una terapia adeguata, occorre determinare la sensibilità del microbo isolato
8. Altri microrganismi. I ceppi di Corynebacterium spp., chiamati difteroidi, spesso contaminano il sangue. Questi microrganismi sono la causa più importante dell'EI e, sorprendentemente, spesso sono gli agenti causali dell'endocardite delle valvole cardiache alterate e anormali.
9. Funghi. Candida albicans, specie Candida non bianche, Histoplasma spp. e Aspergillus spp. sono i funghi più patogeni identificati come causa di EI. Insolitamente, nuovi tipi di funghi e muffe sono responsabili di almeno il 15% dei casi di endocardite cardiaca.
La tabella riassuntiva riporta la frequenza dei casi di malattia da agenti patogeni virali:
Classificazione e tipi
La classificazione internazionale unificata dell'endocardite infettiva viene utilizzata dai cardiologi di tutto il mondo per distinguere i diversi tipi di malattia al fine di raccogliere con precisione sintomi e diagnosi. Sviluppato nel 1975, subisce miglioramenti ogni anno. Secondo la versione moderna, l'endocardite infettiva è solitamente suddivisa come segue:
- Eziologia: cosa ha provocato il quadro clinico della malattia (streptococco, stafilococco, enterococco, ecc.).
- Quali valvole del cuore sono colpite (ad esempio, endocardite della valvola aortica, mitrale).
- Primario: si verifica su una valvola sana nel cuore. Secondario, che si sviluppa su una valvola precedentemente modificata.
- Il decorso della malattia è acuto (fino a 2 mesi dall'esordio delle manifestazioni cliniche) e subacuto (più di 2 mesi dall'esordio delle manifestazioni cliniche).
- Forme specifiche di endocardite infettiva:
- valvole protesiche nel cuore;
- nei tossicodipendenti;
- nosocomiale (forma ospedaliera);
- negli anziani;
- in persone in emodialisi sistemica.
Va notato che queste categorie di pazienti costituiscono il gruppo a più alto rischio. Nei paesi sviluppati, il 10-20% dei casi di EI è attribuibile all’endocardite della valvola protesica. Cresce anche il numero dei pazienti di mezza età e degli anziani, come dimostra il fatto che l’età media delle persone colpite è di 50–60 anni.
Tipi di endocardite secondo la classificazione
Endocardite infettiva primitiva
Il numero di casi di questa forma di patologia è aumentato in modo significativo e attualmente è di circa il 50%. Il seguente insieme di sintomi caratteristici diventa segni di EI primaria:
- La maggior parte dei pazienti ha più di 40 anni.
- Esordio acuto, spesso sotto le “maschere” di altre malattie che si sviluppano nel cuore e in altri organi.
- Elevata resistenza della malattia alla terapia, associata all'inizio tardivo del trattamento e alla presenza di potenti meccanismi di difesa nei batteri contro gli agenti antimicrobici.
- Le valvole del cuore sono colpite.
- Mortalità elevata, che varia dal 50 al 91% per questa forma di EI.
Nelle fasi iniziali della malattia, le manifestazioni cliniche cardiache sono rare. I soffi cardiaci nella maggior parte dei pazienti non vengono rilevati durante la prima consultazione con un medico; di conseguenza, la malattia viene solitamente diagnosticata tardi, nel 30% dei casi - dopo la formazione di un difetto cardiaco. Le principali cause di morte nell'endocardite primaria sono l'insufficienza circolatoria progressiva (90%) e il tromboembolismo (9,5%).
Endocardite infettiva secondaria
Si trovano le seguenti varianti della malattia di questa forma:
- IE a causa di difetti cardiaci reumatici. Attualmente la percentuale di questa variante dell'EI è leggermente diminuita a causa dell'aumento della frequenza della forma primaria della malattia e ammonta al 36–40%. L'EI secondaria delle valvole reumatiche è spesso localizzata sulla valvola mitrale nel cuore. L'esordio più tipico è subacuto;
- IE dovuta a difetti cardiaci congeniti. In media, rappresenta il 9% di tutti i ricoverati con una diagnosi. Le malformazioni congenite sono complicate dallo sviluppo di EI nel 5-26% dei casi, solitamente di età compresa tra 16 e 32 anni, e solo nel 2,6% dei casi l'EI si sviluppa oltre i 40 anni. I sintomi di questa forma di EI sono variabili, ma più spesso sono caratterizzati da un quadro clinico inespressivo e offuscato e da remissioni a lungo termine. Il dotto arterioso pervio è complicato dallo sviluppo di EI nel 20-50%, difetto del setto ventricolare - nel 20-40%, tetralogia di Fallot, stenosi dell'arteria polmonare, coartazione dell'aorta nel cuore - nel 10-25% dei casi, valvola aortica bicuspide - nel 13%;
- endocardite batterica sullo sfondo della cardiosclerosi aterosclerotica e delle lesioni sclerotiche dell'aorta. La frequenza di questa forma è aumentata in modo significativo negli ultimi anni e nella struttura complessiva dell'IE è del 5–7%. Tipici di questa variante dell'EI sono l'età avanzata dei pazienti e un quadro clinico atipico, che spesso si presenta all'esordio della malattia sotto le maschere di malattie caratteristiche. Il processo infettivo determina un decorso rapidamente progressivo;
- endocardite batterica come complicanza della chirurgia cardiaca;
- l'endocardite con valvole artificiali nel cuore si sviluppa nell'1,5-8% dei casi. Intervento chirurgico sullo sfondo della progressione della malattia - 7–21%. Lo sviluppo di endocardite entro 60 giorni dall'impianto nel cuore è considerato un'IE precoce e presenta un tasso di mortalità estremamente elevato, fino al 75%. Con l'EI tardiva, il tasso di mortalità è del 25%. Tassi di mortalità così elevati sono associati alla profonda immunodeficienza presente in questa categoria di pazienti;
- L'endocardite batterica dopo commissurotomia delle valvole aortica e mitrale nel cuore si verifica nel 3-10% dei casi, solitamente 5-8 mesi dopo l'intervento. La prognosi per questa forma di endocardite è sfavorevole.
Fasi
Fase I - iniziale
È caratterizzata da ispessimento e rigonfiamento macroscopico delle valvole e rigonfiamento mucoide istologico della sostanza endocardica cardiaca, lieve infiltrazione linfocellulare con proliferazione di fibroblasti e moderata sclerosi focale. In questa fase, la prognosi per il trattamento è la più favorevole (sopravvivenza frequente 70%).
Stadio II: verrucoso
La comparsa di verruche lungo la linea di chiusura della valvola e/o sull'endocardio parietale nel cuore. A seconda del momento della loro formazione, le verruche valvolari possono essere tenere, sciolte o dense. Istologicamente, con l'endocardite infettiva in questa fase, vengono determinati cambiamenti nel tessuto connettivo di tipo fibroso, gonfiore e disintegrazione delle strutture cardiache, emorragie vascolari e miocardite.
Stadio III: poliposi della verruca
Si formano ulcere e i batteri si attaccano alle valvole. Macroscopicamente si determinano formazioni polipo-verrucose sull'endocardio parietale e sulle valvole, con un quadro istologico caratteristico della forma settica dell'endocardite. La presenza di ulcere e batteri piogeni sui tessuti del cuore. Le valvole vengono colpite più volte, fino alla completa fusione. La lesione non è strettamente localizzata. Il processo patologico coinvolge tutto il rivestimento del cuore (pericardio, miocardio, endocardio), nonché i vasi sanguigni, gli anelli fibrosi delle valvole e i muscoli papillari. Nel miocardio si possono notare edema pronunciato, infiltrazione linfocellulare, degenerazione grassa e proteica e dilatazione dei vasi sinusoidali con stasi. Si osservano aree vecchie e fresche di disorganizzazione del tessuto connettivo del cuore. La fase è caratterizzata dalla continuità del processo morfologico. Un confronto tra i cambiamenti delle valvole e dell'endocardio parietale mostra che queste metamorfosi possono essere considerate come collegamenti successivi dello stesso processo, la distruzione infiammatoria del tessuto connettivo nel cuore.
Endocardite reumatica
L'endocardite reumatica si distingue nella classificazione delle endocarditi infettive (o batteriche) ed è una complicanza delle malattie articolari. Si verifica sullo sfondo dei processi infiammatori nelle borse sinoviali delle articolazioni. È caratterizzata da danni alla valvola mitrale, aortica, alle corde tendinee e all'endocardio parietale nel cuore. La classificazione dell'endocardite reumatica si basa sulla natura e sulla forma del danno alla struttura del tessuto cardiaco.
L'endocardite reumatica è disponibile in diversi tipi:
Forma diffusa caratterizzato da danni diffusi all'intero apparato valvolare. L'ispessimento delle valvole e la comparsa di granulomi portano a disturbi emodinamici. Il trattamento precoce può prevenire complicazioni. Altrimenti, la forma diffusa progredisce in una granulomatosi estesa, che porta all'accorciamento delle valvole e alla formazione di malattie cardiache reumatiche.
Endocardite reumatica verrucosa acuta la cardiopatia è caratterizzata dal deposito di piastrine e fibrina sulle zone colpite, con conseguente formazione di numerose verruche. Se un agente infettivo entra nella cavità cardiaca, esiste il rischio di endocardite infettiva. La terapia antinfiammatoria per la malattia previene lo sviluppo di gravi disturbi cardiaci.
Endocardite verrucosa ricorrente differisce dalla forma acuta nel corso della malattia. La patologia è caratterizzata dalla comparsa periodica di verruche sulle valvole cardiache durante le riacutizzazioni. Per confermare la diagnosi vengono utilizzate la radiografia e l'ecocardiografia del cuore.
Forma fibroplastica dell'endocardite reumatica rappresenta una fase critica. Con questo decorso della malattia si formano cambiamenti irreversibili nel sistema valvolare cardiaco, che possono essere trattati solo con un intervento chirurgico; la probabilità di sopravvivenza con questa forma non è superiore al 20%.
Endocardite infettiva acuta e subacuta
Da un punto di vista clinico la più importante è la divisione dell’endocardite infettiva in acuta e subacuta. Viene effettuato, innanzitutto, non in base al principio del tempo limitato del processo (meno di 2 mesi, più di 2 mesi), ma in base alla gravità, alla forma della malattia, alla velocità, alla frequenza di sviluppo delle complicanze e ai criteri terapeutici prognosi.
Endocardite infettiva acuta
L'endocardite infettiva acuta (AIE) è clinicamente una sepsi con localizzazione primaria dell'infezione sull'apparato valvolare del cuore. Le caratteristiche dell'OIE includono:
- sindrome tossico-infettiva pronunciata (spesso con lo sviluppo di shock tossico-infettivo);
- rapida distruzione delle valvole cardiache con formazione di difetti e insufficienza cardiaca, che talvolta si sviluppano entro 1-2 settimane e richiedono una correzione chirurgica immediata;
- alta incidenza di complicanze tromboemboliche nel cuore;
- frequente formazione di metastasi purulente in vari organi e tessuti;
- elevata mortalità.
L'EAI nel cuore è spesso primaria ed è causata dallo Staphylococcus aureus. In caso di endocardite infettiva nei tossicodipendenti e nelle prime fasi dell'endocardite protesica, il decorso della malattia è acuto. La splenomegalia è un segno di EAI e viene rilevata nell'85-98% dei soggetti deceduti. Infarti splenici e ascessi si riscontrano rispettivamente nel 23,6 e nel 10,5% dei casi. La polmonite settica è osservata nel 21-43% dei pazienti con EAI con danno alle camere cardiache sinistre e nel 66,7% dei pazienti con EAI con danno alle camere cardiache destre.
Danno renale: le manifestazioni cliniche comprendono nefrite acuta con sindrome urinaria moderata. Molto spesso si sviluppano infarti renali (30-60%) a causa dell'embolia delle arterie renali. Con l'endocardite infettiva, l'epatite tossica si sviluppa abbastanza spesso (30-40%). La sindrome DIC con formazione di ulcere acute nello stomaco, nel bulbo duodenale e sanguinamento gastrointestinale si verifica nel 45,8% dei casi. Le complicanze immunologiche dell'endocardite si sviluppano raramente a causa del decorso fulminante della malattia.
Endocardite infettiva subacuta
L'endocardite infettiva subacuta (PIE) è un'infezione della valvola cardiaca. In caso di PIE, il quadro clinico della sepsi è raramente osservato ed è caratteristico il frequente sviluppo di complicanze immunologiche:
- giada;
- vasculite;
- sinovite;
- polisierosite.
Questa variante della malattia si verifica con un agente patogeno a bassa virulenza (streptococco, stafilococco epidermico). La forma batterica o reumatica dell'endocardite, di regola, si sviluppa in pazienti con pregressa patologia cardiaca ed è caratterizzata da una prognosi più favorevole.
Nell'EI subacuta, il quadro clinico si sviluppa gradualmente nell'arco di 2-6 settimane ed è caratterizzato dalla varietà e dalla gravità dei sintomi principali. Le manifestazioni più comuni di danno immunitario sono vasculite, artralgia (artrite), mialgia, glomerulonefrite, miocardite. Le vasculiti periferiche si manifestano con petecchie, noduli di Osler (emboli settici microvascolari), macchie di Roth (emorragie retiniche rilevate dall'esame del fondo oculare) e macchie di Geneway (macchie emorragiche da 1 a 4 mm sui palmi delle mani e sulle piante dei piedi). Con la PIE, il sistema muscolo-scheletrico è abbastanza spesso interessato ed è tipica una diminuzione del peso corporeo.
Decorso subacuto prolungato dell'endocardite infettiva
Il quadro clinico è significativamente diversificato e comprende sintomi di intossicazione settica infettiva, insufficienza cardiaca e sindromi cliniche associate a danni agli organi viscerali. Tra questi, il principale è il danno al cuore e ai vasi sanguigni. Tuttavia, il quadro clinico sviluppato del decorso subacuto dell'EI non viene immediatamente osservato e l'insieme iniziale dei sintomi è vario.
Secondo la principale sindrome clinica, si distinguono varie varianti:
- renale;
- tromboembolico;
- anemico;
- coronario;
- splenomegalico;
- epatosplenomegalico;
- cerebrale;
- poliartritico;
- afebbrile.
Il decorso clinico dell'EI e la prognosi della malattia sono in gran parte determinati dall'attività del processo patologico. Esistono gradi di attività bassa, moderata e massima dell'endocardite infettiva.
Manifestazioni cliniche di endocardite nella tabella (incidenza dei casi in%):
Sintomi di endocardite batterica
L'endocardite batterica non è sempre accompagnata da sintomi. In alcuni casi, la malattia può svilupparsi improvvisamente, senza nemmeno passare attraverso le fasi. Spesso i sintomi sono secondari e non indicano problemi cardiaci. Tutto può iniziare in modo abbastanza prosaico. Inizia il naso che cola e talvolta si sviluppa la sinusite, come nel caso di altre malattie. Una persona non ha tempo per impegnarsi nel trattamento. Questo spesso finisce in modo disastroso; il paziente può causare danni irreparabili al suo cuore. Senza attribuire importanza ai sintomi che accompagnano qualsiasi malattia infettiva, il paziente perde allegramente l'insorgenza delle complicanze di una malattia semplice, una delle quali è l'endocardite batterica.
Il trattamento deve essere completo per tutti i sintomi del raffreddore:
- nausea;
- febbre, delirio;
- un forte aumento della temperatura senza una ragione apparente;
- mancanza di respiro, sensazione di mancanza d'aria;
- tosse secca, parossistica;
- dolore, articolazioni doloranti;
- disturbi del sonno, ansia, debolezza;
- brividi seguiti da un senso di soffocamento insopportabile.
Ad esempio, mal di gola. Di conseguenza, è causato da alcuni agenti patogeni infettivi. Se non trattate, iniziano a diffondersi in tutto il corpo, possono entrare nel cuore e rimanere sulle valvole, causando infiammazioni e danni ai tessuti e agli elementi strutturali.
Una diagnosi assoluta di endocardite batterica è considerata la conferma di almeno due colture batteriche su tre per l'agente patogeno. Il sangue viene prelevato in condizioni sterili (da vene diverse) e se in due casi su tre viene confermata la crescita dello stesso agente patogeno, la diagnosi è altamente probabile in presenza del cosiddetto complesso di sintomi minori.
I sintomi minori includono eruzioni cutanee caratteristiche dell'endocardite batterica. Compaiono sul letto ungueale, sulla mucosa orale e sulla congiuntiva. Il metodo diagnostico più importante è la conferma ecografica del danno alle valvole aortica e mitrale nel cuore. Se la malattia viene riconosciuta come infettiva, la terapia antibatterica dovrebbe essere completa e durare esattamente quanto prescritto dal medico. L'assunzione di antibiotici per tre o cinque giorni, determinata indipendentemente o su consiglio di un vicino, non porterà a nulla di buono.
Innanzitutto l'endocardite batterica è caratterizzata da un danno alla valvola aortica. La valvola aortica e le sue cuspidi, alle quali sono attaccate le vegetazioni, non possono trattenere a lungo una grande massa. E le particelle si staccano dai cuori e vengono portate via dal flusso sanguigno. Queste sono le cosiddette metastasi settiche che si diffondono in tutto il corpo. La seconda fonte di malattia è la valvola mitrale, dove si staccano anche le vegetazioni in decomposizione e vengono trasportate dal flusso sanguigno sistemico. Nell'endocardite batterica destra, si attaccano alla valvola tricuspide e vengono trasportati nell'arteria polmonare, provocando un ascesso polmonare.
Il trattamento dell'endocardite infettiva ha lo scopo di rimuovere l'infezione non solo dal cuore, ma anche dal sangue. Entro un mese dalla terapia si verificano spesso recidive di endocardite. Se i sintomi si ripetono 6 settimane dopo la fine del trattamento, non si tratta di una recidiva, ma di una nuova infezione. L'esame del sangue deve essere effettuato al mattino e a stomaco vuoto. L’endocardite batterica, se non trattata, porta alla distruzione delle valvole cardiache e all’insufficienza cardiaca.
Diagnostica
L'endocardite infettiva comporta misure diagnostiche complesse, a causa di un quadro sfocato di sintomi caratteristici di molte malattie e di una vasta gamma di microrganismi provocatori. Senza questo, è impossibile prescrivere un trattamento adeguato.
Prendendo la storia
I primi sintomi di endocardite infettiva iniziano a comparire 2 settimane dopo l'incubazione dell'agente patogeno. I segni clinici sono qualsiasi manifestazione anomala, dai sintomi cancellati all'insufficienza cardiaca acuta sullo sfondo di una grave insufficienza valvolare con rapida distruzione dei lembi. L'esordio può essere acuto (Staphylococcus aureus) o graduale (Viridans streptococcus).
Esame fisico
Nel decorso tipico dell'endocardite infettiva viene eseguito un esame generale che rivela numerosi sintomi aspecifici:
- pelle pallida con una tinta giallo-grigiastra. La pelle pallida è spiegata dall'anemia caratteristica dell'endocardite infettiva e una tinta itterica della pelle diventa un segno che il fegato è coinvolto nel processo patologico;
- la perdita di peso è un sintomo tipico dei pazienti con endocardite infettiva. A volte si sviluppa molto rapidamente, più spesso entro poche settimane meno 15-20 kg;
- cambiamenti nelle falangi terminali delle dita sotto forma di "bacchette" e unghie del tipo "vetro da orologio", che compaiono durante un decorso relativamente lungo della malattia (circa 2-3 mesi);
- sintomi periferici dovuti a vasculite o embolia. Sulla pelle compaiono dolorose eruzioni petecchiali emorragiche; sono di piccole dimensioni, non impallidiscono alla pressione e sono indolori alla palpazione. Le petecchie sono spesso localizzate sulla superficie anteriore superiore del torace (dove si trova il cuore), sulle gambe e col tempo acquisiscono una tinta marrone e scompaiono. Talvolta le emorragie sono localizzate sulla piega transitoria della congiuntiva della palpebra inferiore (macchie di Lukin) o sulle mucose del cavo orale. Le macchie di Roth sono simili alle macchie di Lukin: piccole emorragie nella retina dell'occhio, aventi anche una zona sbiancante al centro, che vengono rilevate durante la diagnostica speciale del fondo;
- emorragie lineari sotto le unghie. I nodi di Osler sono formazioni dolorose, rossastre e tese delle dimensioni di un pisello, situate nella pelle e nel tessuto sottocutaneo sui palmi delle mani, sulle dita e sulle piante dei piedi. Ma vale la pena ricordare che i sintomi periferici dell'endocardite infettiva vengono raramente rilevati durante la diagnosi.
Altre manifestazioni esterne della malattia
I sintomi dell'endocardite sono causati dal danno immunitario agli organi interni, dal tromboembolismo e dallo sviluppo di lesioni settiche. Sintomi neurologici che sono segni di complicanze cerebrali (infarto cerebrale, che si sviluppa a seguito di tromboembolia dei vasi cerebrali, ematomi intracerebrali, ascesso cerebrale, meningite e altre malattie). I segni di embolia polmonare (PE), spesso rilevati durante la diagnostica quando la valvola tricuspide è danneggiata (soprattutto nei tossicodipendenti), sono mancanza di respiro, soffocamento, dolore toracico, cianosi.
Palpazione e percussione del cuore
Si consiglia di eseguire la palpazione e la percussione del cuore, che consentiranno di diagnosticare la localizzazione della lesione infettiva (valvola aortica, mitrale, tricuspide). Così come la presenza di una malattia concomitante, cardiaca o meno, contro la quale si è sviluppata l'endocardite infettiva. Nella maggior parte dei casi si osservano segni di espansione e ipertrofia del ventricolo sinistro: spostamento a sinistra dell'impulso apicale e bordo sinistro della relativa ottusità del cuore, impulso apicale diffuso e aumentato.
Auscultazione del cuore
Diagnostica di laboratorio
Durante la diagnosi di laboratorio della malattia, un esame del sangue generale rivela leucocitosi, anemia normocromica e un aumento della velocità di sedimentazione degli eritrociti. Il 50% dei pazienti presenta un fattore reumatoide elevato. Si notano positività alla proteina C-reattiva e ipergammaglobulinemia. In generale analisi delle urine - microematuria con o senza proteinuria. La diagnostica biochimica del sangue rivela ipoalbuminemia, azotemia e aumento dei livelli di creatinina. Il coagulogramma può mostrare un tempo di protrombina leggermente aumentato, un indice di protrombina Quick ridotto e un aumento del livello di fibrinogeno.
Diagnostica strumentale
L’imaging, in particolare l’ecocardiografia, è raccomandato e svolge un ruolo chiave nella diagnosi e nella gestione dei pazienti con EI. L'ecocardiografia è utile anche per valutare la prognosi dei pazienti con endocardite, l'andamento del trattamento e dopo l'intervento chirurgico.
Anche l'ecocardiografia transesofagea (TEE) è consigliata e svolge un ruolo importante prima e durante l'intervento chirurgico (ecocardiografia intraoperatoria). Ma la valutazione dei pazienti con qualsiasi stadio della malattia da EI non si limita più alla consueta ecocardiografia. Dovrebbe includere MSCT, MRI, tomografia a emissione di positroni (PET) o altri metodi diagnostici funzionali.
Altro diagnostica
I raggi X possono rivelare un'espansione dei confini dell'ombra nel cuore. In caso di infarto polmonare si riscontrano ombre sparse a forma di cuneo nel campo medio o inferiore, solitamente a destra. In dinamica, i cambiamenti scompaiono dopo 7-10 giorni, ma possono verificarsi polmonite ipostatica e pleurite emorragica. In caso di insufficienza ventricolare sinistra si può individuare un quadro di edema polmonare.
La tomografia computerizzata (contrasto), la risonanza magnetica (programma vascolare) o l'angiografia dei vasi cerebrali dovrebbero essere eseguite in tutti i pazienti con endocardite infettiva attiva delle camere sinistre del cuore, così come nei pazienti in remissione che hanno una storia di complicanze neurologiche dovute all'endocardite infettiva (tromboembolia dei vasi cerebrali, ictus emorragico, cefalee persistenti) allo scopo di diagnosticare aneurismi micotici del cuore e di altri organi. Aneurismi cerebrali micotici si verificano in circa il 2% dei pazienti con endocardite infettiva. Le rotture degli aneurismi portano alla morte.
Il trattamento chirurgico degli aneurismi nel contesto di un'insufficienza cardiaca grave è associato ad un rischio elevato, ma il trattamento chirurgico dei difetti cardiaci può anche portare ad una maggiore probabilità di emorragia intracerebrale dovuta all'eparinizzazione durante il bypass cardiopolmonare. La diagnosi tempestiva degli aneurismi consente di determinare la tattica del trattamento chirurgico. La tomografia computerizzata del torace (anche con contrasto polare) è indicata per i pazienti per chiarire il quadro del danno polmonare, localizzazione e diffusione degli ascessi, falsi aneurismi aortici nell'endocardite infettiva della valvola aortica.
Quale risultato è possibile per i bambini?
In accordo con le raccomandazioni sviluppate dal Comitato di Esperti dell'American Heart Association (1997), la profilassi antibiotica è maggiormente indicata per quei bambini e adolescenti nei quali l'EI non solo si sviluppa significativamente più spesso rispetto ai dati sulla popolazione (rischio moderato), ma è anche associato ad elevata mortalità (alto rischio).
Di seguito sono riportati i gruppi a rischio per lo sviluppo di IE.
Gruppo ad alto rischio:
- valvole cardiache artificiali (comprese bioprotesi e allotrapianti);
- storia dell'IE;
- cardiopatie congenite complesse “blu” (tetralogia di Fallot, trasposizione delle grandi arterie, ecc.);
- shunt polmonari sistemici operati.
Gruppo a rischio moderato:
- difetti cardiaci congeniti non operati - dotto arterioso pervio, DIV, ASD primario, coartazione dell'aorta, valvola aortica bicuspide;
- difetti cardiaci acquisiti;
- Cardiomiopatia ipertrofica;
- MVP con rigurgito mitralico e/o ispessimento delle valvole cardiache.
Gruppo a basso rischio:
- ASD secondario isolato;
- difetti cardiaci congeniti operati - ASD, VSD, dotto arterioso pervio;
- storia di bypass aortocoronarico;
- prolasso della valvola mitrale senza rigurgito mitralico;
- soffi cardiaci funzionali o “innocenti”;
- storia di malattia di Kawasaki senza disfunzione valvolare;
- storia di febbre reumatica senza malattia cardiaca.
Malattie sotto forma di MVP si riscontrano spesso nei bambini e negli adolescenti e non sono sempre il riflesso di eventuali disturbi valvolari strutturali o funzionali. In assenza di cambiamenti strutturali nei lembi valvolari, soffio sistolico ed EchoCG - sintomi di rigurgito mitralico (o con un grado minimo di gravità), il rischio di sviluppare IE nei bambini e negli adolescenti con MVP non differisce dalla popolazione. La profilassi antibiotica della malattia in questi casi non è praticabile. Se la MVP è accompagnata da un rigurgito mitralico moderato (ancora più pronunciato), quest'ultimo contribuisce alla comparsa di flussi sanguigni turbolenti e quindi aumenta la probabilità di adesione batterica alla valvola durante la batteriemia. Pertanto, per questi bambini e adolescenti è indicata la profilassi antibiotica. La MVP può essere una conseguenza di alterazioni della valvola mixomatosa, accompagnate da un ispessimento dei lembi, mentre lo sviluppo del rigurgito è possibile durante l'attività fisica. Anche questi bambini e adolescenti corrono un rischio medio di sviluppare IE.
La profilassi antibiotica dell'endocardite è indicata per tutti i bambini e gli adolescenti che rientrano in categorie a rischio elevato o moderato durante l'esecuzione di varie procedure odontoiatriche, interventi chirurgici e procedure diagnostiche strumentali, che possono essere accompagnate da batteriemia transitoria: estrazione dentale, manipolazione parodontale, interventi sulla radice del dente, adenotomia, tonsillectomia, biopsia delle mucose delle vie respiratorie e del tratto gastrointestinale, cistoscopia, ecc. Insieme a ciò, è estremamente importante spiegare a bambini, adolescenti e genitori la necessità di un'attenta cura igienica del cavo orale e di una consultazione tempestiva consultare un medico per qualsiasi infezione batterica intercorrente.
La prognosi è determinata dal tipo di microbo provocante, dalla patologia cardiaca di fondo, dalla natura del processo, dalla presenza di complicanze, dalla tempestività e dall'adeguatezza del trattamento. È possibile una guarigione completa con una prognosi favorevole a lungo termine in assenza di embolia e segni di insufficienza cardiaca e renale. Nonostante i risultati della moderna medicina clinica, la mortalità tra i bambini e gli adolescenti rimane elevata, circa il 20%.
Complicazioni
Insufficienza cardiaca
Quando le valvole del cuore sono danneggiate, si verifica la loro insufficienza. La disfunzione miocardica che si verifica sullo sfondo di un processo negativo, a sua volta, provoca miocardite o infarto. Tutte le strutture del cuore sono coinvolte nel processo. Gli emboli nelle arterie coronarie, l'eventuale blocco dell'imboccatura dell'arteria coronaria da parte di un frammento di vegetazione o la distruzione di una cuspide della valvola aortica portano infine allo scompenso cardiaco. In questo caso viene prescritta una terapia conservativa, che tiene conto dell'endocardite infettiva nel regime di trattamento. Tutte le misure mediche non sono specifiche e vengono eseguite in conformità con le raccomandazioni del Ministero della Salute per il trattamento dell'insufficienza cardiaca cronica.
Complicazioni neurologiche
Complicanze neurologiche si sviluppano in oltre il 40% dei pazienti con diagnosi di endocardite infettiva (reumatica). Ciò si verifica a seguito di un'embolia con frammenti di vegetazione. Le manifestazioni cliniche variano ampiamente e includono:
- ictus ischemico ed emorragico;
- embolia cerebrale latente;
- ascesso cerebrale;
- meningite;
- encefalopatia tossica;
- apoplessia;
- aneurisma infettivo sintomatico o asintomatico.
Aneurismi infettivi
Aneurismi infettivi (fungini) di varie localizzazioni si formano a seguito dell'embolia settica vasa-vasorum o della penetrazione diretta dell'infezione nella parete vascolare. I segni clinici di aneurisma infettivo sono vari (sintomi neurologici focali, cefalea, ictus emorragico), quindi l'angiografia dovrebbe essere eseguita per determinare l'IA intracranica in ogni caso di EI con sintomi neurologici. La tomografia computerizzata (TC) e la risonanza magnetica (MRI) possono diagnosticare l'IA con elevata sensibilità e specificità, ma l'angiografia rimane il gold standard nella diagnosi di IA e dovrebbe essere utilizzata in tutti i casi in cui vi siano dubbi sui risultati ottenuti.
Gli aneurismi rotti hanno una prognosi sfavorevole. Nei casi con aneurismi infettivi grandi, dilatati o rotti, si raccomanda un trattamento neurochirurgico o endovascolare. Dopo una complicanza neurologica, la maggior parte dei pazienti con endocardite infettiva ha ancora almeno un'indicazione all'intervento chirurgico. Il rischio di deterioramento neurologico postoperatorio è basso dopo un'embolia cerebrale latente o un attacco ischemico transitorio. Dopo un ictus ischemico, la chirurgia cardiaca non rappresenta una controindicazione. L’intervallo di tempo ottimale tra ictus e trattamento chirurgico è controverso a causa della ricerca insufficiente.
Se mediante TC si esclude un sanguinamento cerebrale e il deficit neurologico non è troppo grave, si raccomanda di non ritardare il trattamento chirurgico. Naturalmente, se ci sono indicazioni (insufficienza cardiaca, infezione incontrollata, embolie ripetute). L'operazione ha un livello di rischio neurologico relativamente basso (3-6%). Nei casi di emorragia intracranica, la prognosi neurologica è peggiore e l'intervento chirurgico deve essere ritardato di almeno un mese. Se è urgentemente necessario un intervento cardiaco, è necessaria una stretta collaborazione con l’équipe neurologica.
Insufficienza renale acuta (IRA)
Una complicanza comune dell'endocardite infettiva, diagnosticata nel 30% dei pazienti con diagnosi confermata. È estremamente sfavorevole in termini di prognosi.
Cause di insufficienza renale acuta:
- glomerulonefrite;
- disturbi emodinamici in caso di insufficienza cardiaca, sepsi grave, dopo intervento cardiaco;
- effetti tossici della terapia antimicrobica, il più delle volte causati da aminoglicosidi, vancomicina e alte dosi di penicillina;
- nefrotossicità dei mezzi di contrasto utilizzati per le radiografie.
Alcuni pazienti possono richiedere l'emodialisi, ma l'insufficienza renale acuta è spesso reversibile. Per prevenire l’AKI, le dosi di antibiotici devono essere aggiustate in base alla clearance della creatinina con un attento monitoraggio delle concentrazioni sieriche (aminoglicosidi e vancomicina). La radiografia con mezzi di contrasto nefrotossici dovrebbe essere evitata in soggetti con scarsa emodinamica o con insufficienza renale sottostante.
Complicazioni reumatiche
I sintomi muscoloscheletrici (dolori articolari, mialgia, mal di schiena) sono comuni nell'endocardite infettiva e possono essere le prime manifestazioni della malattia. L'artrite periferica si verifica nel 14% e la spondilosi nel 3-15% dei casi. Una scansione TC o MRI della colonna vertebrale deve essere eseguita nei pazienti con endocardite che avvertono mal di schiena. Al contrario, l'ecocardiografia dovrebbe essere eseguita in soggetti con diagnosi accertata di spondilosi piogenica in presenza di fattori di rischio per endocardite infettiva.
Ascesso di milza
Nonostante la prevalenza dell’embolia splenica, l’ascesso è una complicanza abbastanza rara dell’EI. Dovrebbe essere escluso nei pazienti con febbre persistente e batteriemia. Metodi diagnostici: TC, risonanza magnetica o ecografia della cavità addominale. Il trattamento consiste nella scelta di un'adeguata terapia antibatterica. La rimozione della milza può essere presa in considerazione in caso di rottura della milza o di ascessi di grandi dimensioni che non rispondono agli antibiotici. L'intervento dovrebbe essere eseguito prima dell'intervento chirurgico alle valvole cardiache, a meno che quest'ultimo non sia urgente.
Miocardite, pericardite
L'insufficienza cardiaca può essere una manifestazione di miocardite, che è spesso associata alla formazione di ascessi. Disturbi complessi del ritmo e della conduzione sono spesso causati da un danno miocardico e rappresentano un indicatore prognostico sfavorevole. La pericardite può essere associata ad un ascesso, miocardite o batteriemia, spesso come risultato di un'infezione da stafilococco. aureola. La pericardite suppurativa è rara e può richiedere il drenaggio chirurgico. In alcuni casi, la rottura di pseudoaneurismi o fistole può comunicare con il pericardio e portare a conseguenze fatali.
Recidive ed endocarditi infettive ripetute
Il rischio di casi ricorrenti di endocardite infettiva tra i sopravvissuti varia dal 2,7% al 22,5%. Esistono due tipi di recidive: recidiva e reinfezione.
Una recidiva è considerata un episodio ripetuto di EI causato dagli stessi microrganismi dell'episodio precedente della malattia. La reinfezione è solitamente chiamata endocardite causata da altri microrganismi o dagli stessi batteri più di 6 mesi dopo il primo episodio. Il tempo tra gli episodi è solitamente più breve in caso di recidiva che in caso di reinfezione. In termini generali, un episodio di EI causato dallo stesso tipo di microrganismi prima dei 6 mesi dall'episodio iniziale rappresenta una recidiva, mentre dopo i 6 mesi rappresenta una reinfezione.
Trattamento
L'inizio precoce del trattamento antibatterico, prima delle manifestazioni cliniche dell'endocardite infettiva (o della forma reumatica), è la condizione principale per una prognosi favorevole della terapia. Per fare ciò è necessario utilizzare principi medici efficaci: “anticipazione”, “allerta settica alternativa”, registrazione/monitoraggio dispensario dei pazienti a rischio.
Regime di trattamento conservativo con antibiotici:
| Provocatore di malattie | Antibiotico consigliato | Nota |
| Indefinito | Oxacillina + Cefazolina + Amoxicillina + aminoglicosidi | Se le condizioni del paziente sono gravi, viene immediatamente prescritto un regime di trattamento antimicrobico. La vancomicina può essere combinata con gli aminoglicosidi, ma si deve considerare un aumento della nefrotossicità con questa combinazione. Imipenem è prescritto per il trattamento di casi gravi (insufficienza cardiaca). Si sconsiglia la somministrazione per lungo tempo. Dopo aver ricevuto i risultati di uno studio microbiologico, passare alla terapia tenendo conto dell'eziologia accertata. |
| Stafilococco | I ceppi meticillino-sensibili di Str. aureus (MSSA) Stafilococchi coagulasi-negativi Oxacillina + aminoglicosidi Cefazolina + aminoglicosidi Cefuroxima + aminoglicosidi Ceftriaxone + rifampicina Ceppi di Str. resistenti alla meticillina. aureo (MRSA) Stafilococchi coagulasi-negativi resistenti alla meticillina Vancomicina Linezolid Ciprofloxacina + Rifampicina Rifampicina + Co-trimaxazolo |
Nei casi di efficacia senza aminoglidi è meglio farne a meno, data l'oto- e nefrotossicità. Se sei allergico ai β-lattamici, puoi prescrivere la lincomicina o la clindamicina. La rifampicina per uso endovenoso viene somministrata con glucosio al 5% (almeno 125 ml di glucosio). Nei casi in cui la terapia senza aminoglicosidi risulta efficace è preferibile farne a meno. Non ha un'efficacia inferiore alla vancomicina. |
| Streptococchi viridanti | Benzilpenicillina Ampicillina Ampicillina/sulbactam Amoxicillina/clavulanato Ceftriaxone Vancomicina |
|
| Enterococchi | Ampicillina Ampicillina/sulbactam Amoxicillina/clavulanato Vancomicina, linezolid |
|
| Pseudomonas aeruginosa | Imipenem + aminoglicosidi Ceftazidima + aminoglicosidi Cefoperazone + aminoglicosidi Ciprofloxacina + aminoglicoside Sulperazone + aminoglicosidi Cefepime + aminoglicosidi |
|
| Batteri del genere Enterobacteri acea | Ceftriaxone + aminoglicosidi Ampicillina/sulbactam + aminoglicosidi Cefotaxime + aminoglicosidi Ciprofloxacina + aminoglicosidi, Thienam, Sulperazone |
Quando si isolano ceppi di Enterobacteriaceae produttori di β-lattamasi a spettro esteso (ESBL), è consigliabile proseguire la terapia cardiaca con carbopenemi (Imipenem) o carbossipenicilline protette con inibitori. |
| Funghi | Amfotericina B Fluconazolo |
Viene utilizzato per via endovenosa per le micosi sistemiche gravi ed è altamente tossico. Viene somministrato solo con glucosio. |
| Gruppo di microrganismi NASEK | Ceftriaxone Ampicillina/sulbactam + aminoglicosidi |
Intervento chirurgico
L’approccio classico al trattamento della sepsi prevede 3 obiettivi principali:
- macroorganismo;
- microrganismi;
- fonte di infezione.
Nell'endocardite infettiva, la fonte dell'infezione è localizzata nella cavità cardiaca e l'accesso ad essa è un'operazione tecnicamente difficile associata ad un alto rischio per la vita del paziente. Pertanto, devono esserci ragioni sufficientemente convincenti per il trattamento chirurgico. I pazienti con endocardite infettiva vengono operati nei casi in cui il trattamento conservativo è inefficace. Riassumendo l'esperienza dei principali cardiochirurghi nazionali ed esteri nel trattamento invasivo dell'endocardite infettiva valvolare attiva, possiamo evidenziare i segni più importanti su cui si basano le indicazioni per la chirurgia cardiaca. La presenza di almeno uno dei seguenti fattori determina la necessità di un intervento chirurgico precoce. Questi includono:
- insufficienza cardiaca progressiva;
- batteriemia nonostante un adeguato trattamento antibiotico per quattro settimane;
- embolie ripetute;
- endocardite causata dalla flora fungina;
- sviluppo di disturbi del ritmo cardiaco sotto forma di blocco atrioventricolare, pericardite, cioè complicazioni causate dalla transizione del processo alle strutture che circondano la valvola;
- endocardite protesica;
- recidiva della malattia dopo un adeguato ciclo di trattamento di otto settimane con gli antibiotici più efficaci.
Le indicazioni al trattamento chirurgico dei difetti valvolari cardiaci di origine infettiva in fase di remissione sono assolute nei casi in cui il paziente abbia indicazioni di embolie ripetute o l'esame ecocardiografico riveli ampie vegetazioni prevalenti che sono potenziali fonti di embolie. Negli altri casi le indicazioni all'intervento chirurgico sono le stesse dei difetti di altra origine.
La principale controindicazione al trattamento invasivo è la grave condizione generale del paziente. Il trattamento chirurgico è controindicato nei pazienti con shock settico non controllato dalla terapia farmacologica, nonché in stato comatoso dopo un'embolia settica nei vasi cerebrali. Il metodo chirurgico riflette il principio di base del trattamento del processo infettivo e della sepsi, che consiste nel rimuovere la fonte dell'infezione sullo sfondo della terapia antibatterica generale. La correzione dell'emodinamica prodotta in questo caso aiuta a normalizzare la circolazione sanguigna, eliminare il pericolo di embolia arteriosa e quindi mettere il corpo in condizioni che facilitano la lotta contro una malattia così grave come l'endocardite settica acuta e subacuta.
L'endocardite infettiva (IE) è un'infiammazione poliposi-ulcerosa infettiva dell'endocardio, accompagnata dalla formazione di vegetazioni sulle valvole o sulle strutture sottovalvolari, dalla loro distruzione, disfunzione e formazione di insufficienza valvolare. Molto spesso, i microrganismi patogeni colpiscono le valvole e le strutture sottovalvolari precedentemente alterate, anche nei pazienti con cardiopatia reumatica, alterazioni degenerative delle valvole, MVP e valvole artificiali. Questa è la cosiddetta endocardite infettiva secondaria. In altri casi, una lesione infettiva dell'endocardio si sviluppa sullo sfondo di valvole invariate (endocardite infettiva primaria).
Negli ultimi anni, l’incidenza dell’EI primaria è aumentata al 41-54% di tutti i casi della malattia. Esistono anche decorsi acuti e subacuti di endocardite infettiva. L’endocardite protratta, piuttosto comune in passato, oggi è molto rara. Sono colpite più spesso le valvole mitrale e aortica, meno frequentemente le valvole tricuspide e polmonare. Il danno all'endocardio del cuore destro è più comune tra i tossicodipendenti per iniezione. L'incidenza annuale dell'endocardite infettiva è di 38 casi ogni 100mila abitanti e le persone in età lavorativa (20-50 anni) hanno maggiori probabilità di ammalarsi.
Nell’ultimo decennio molti autori hanno notato un aumento dell’incidenza dell’EI, che è associato all’uso diffuso di apparecchiature mediche invasive, alla chirurgia cardiaca più frequente, all’aumento della tossicodipendenza e al numero di persone con stati di immunodeficienza. La mortalità con EI rimane al livello del 40-60%, raggiungendo l'80% nelle persone anziane e senili. Questi dati evidenziano le sfide nella diagnosi tempestiva e nel trattamento efficace della malattia.
Classificazione dell'endocardite infettiva

Per origine si distingue l'endocardite infettiva primaria e secondaria. Il primario di solito si verifica in condizioni settiche di varie eziologie sullo sfondo di valvole cardiache invariate. Secondario: si sviluppa sullo sfondo della patologia esistente dei vasi sanguigni o delle valvole a causa di difetti congeniti, reumatismi, sifilide, dopo un intervento chirurgico di sostituzione della valvola o commissurotomia.
Secondo il decorso clinico si distinguono le seguenti forme di endocardite infettiva:
- acuto – durata fino a 2 mesi, si sviluppa come complicazione di una condizione settica acuta, lesioni gravi o manipolazioni mediche sui vasi sanguigni, cavità cardiache: sepsi angiogenica (catetere) nosocomiale (in ospedale). È caratterizzato da un agente patogeno altamente patogeno e gravi sintomi settici.
- subacuto – durata superiore a 2 mesi, si sviluppa con un trattamento insufficiente dell'endocardite infettiva acuta o della malattia di base.
- protratto.
Nei tossicodipendenti, le caratteristiche cliniche dell'endocardite infettiva sono la giovane età, la rapida progressione dell'insufficienza ventricolare destra e l'intossicazione generale, il danno polmonare infiltrativo e distruttivo.
Nei pazienti anziani, l'endocardite infettiva è causata da malattie croniche dell'apparato digerente, presenza di focolai infettivi cronici e danni alle valvole cardiache. Esistono endocarditi infettive attive e inattive (guarite). A seconda dell'entità del danno, l'endocardite si manifesta con un danno limitato alle valvole cardiache o con un danno che si estende oltre la valvola.
Si distinguono le seguenti forme di endocardite infettiva:
- tossico-infettivo – caratterizzato da batteriemia transitoria, adesione del patogeno all'endocardio alterato, formazione di vegetazioni microbiche;
- infettivo-allergico o immunoinfiammatorio - sono caratteristici i segni clinici di danno agli organi interni: miocardite, epatite, nefrite, splenomegalia;
- distrofico – si sviluppa con la progressione del processo settico e dell’insufficienza cardiaca. È caratteristico lo sviluppo di danni gravi e irreversibili agli organi interni, in particolare la degenerazione tossica del miocardio con numerose necrosi. Il danno miocardico si verifica nel 92% dei casi di endocardite infettiva prolungata.
Cause dell'endocardite

- In precedenza, la causa principale dell'endocardite infettiva erano gli streptococchi. Questa infezione ha risposto bene al trattamento. Al giorno d’oggi, a causa dell’uso diffuso degli antibiotici, la gamma dei patogeni microbici è cambiata. Ora l'endocardite infettiva è causata da stafilococchi, Pseudomonas aeruginosa e microrganismi fungini. Le malattie causate da questi agenti patogeni sono più gravi, in particolare l'endocardite causata da infezioni fungine. Spesso si verifica un'infezione nel sito della valvola protesica. Questo tipo di endocardite infettiva è chiamata endocardite protesica e si sviluppa entro due mesi dall’intervento di sostituzione della valvola cardiaca. In questo caso, l'agente eziologico della malattia è spesso lo streptococco. I pazienti con difetti cardiaci, in particolare malattia della valvola aortica, difetto del setto ventricolare e coartazione dell'aorta, sono ad alto rischio di sviluppare endocardite.
- Ma l’endocardite infettiva può colpire anche una persona sana. Ciò è facilitato dal sovraccarico fisico e mentale e dalla diminuzione dell'immunità. Per raggiungere la valvola, il microrganismo deve entrare nel sangue. Le persone entrano continuamente in contatto con i germi. È stato dimostrato che anche durante la normale spazzolatura dei denti una piccola quantità di microbi entra nel flusso sanguigno. Ma questo non significa che tutti coloro che si lavano i denti si ammaleranno. Attraverso il flusso sanguigno, il microrganismo entra nel cuore e se le valvole cardiache sono danneggiate, si attacca facilmente ad esse e inizia a moltiplicarsi, creando colonie di microrganismi, la cosiddetta vegetazione microbica. La vegetazione microbica può distruggere rapidamente la valvola. Pezzi di lembi o colonie di microrganismi potrebbero staccarsi dalla valvola e i lembi potrebbero rompersi. Pezzi della valvola o della vegetazione microbica possono entrare nel cervello attraverso il flusso sanguigno e causare infarti cerebrali, accompagnati da paralisi, paresi e altri disturbi neurologici. La valvola distrutta non può svolgere la sua funzione e presto si verifica un'insufficienza cardiaca. L’insufficienza cardiaca progredisce molto rapidamente perché il cuore non ha il tempo di utilizzare le sue capacità compensatorie.
Sintomi di endocardite infettiva
L'endocardite infettiva può iniziare in modo acuto o graduale. Attualmente prevalgono le forme cancellate della malattia con esordio prolungato e quadro clinico atipico, che complicano significativamente la diagnosi tempestiva. I primi sintomi di endocardite infettiva sono febbre e intossicazione generale, che si manifesta con debolezza e malessere generale, mal di testa, perdita di appetito e perdita di peso, dolore ai muscoli e alle articolazioni. L'aumento della temperatura durante l'endocardite infettiva non è immediatamente regolare ed è spesso accompagnato da brividi e sudorazione. Nella fase iniziale della malattia i disturbi cardiaci sono rari, anche se si osserva quasi sempre un aumento persistente della frequenza cardiaca.
Dopo alcune settimane dall'esordio dell'endocardite infettiva, l'aumento della temperatura diventa più o meno persistente, spesso fino a valori elevati (38-39°C), ed è accompagnato da forti brividi e sudorazione profusa. A poco a poco compaiono segni di danno cardiaco sotto forma di mancanza di respiro, che peggiora con lo sforzo, dolore toracico e aritmie. Durante questo periodo, il medico può ascoltare una varietà di rumori nell'area della valvola, che molto spesso fanno sospettare un'endocardite infettiva. Nei casi gravi di endocardite infettiva possono comparire i primi segni di insufficienza cardiaca: respiro frequente e superficiale, tosse che peggiora in posizione orizzontale e gonfiore agli arti inferiori. Poiché l'endocardite infettiva colpisce non solo il cuore, ma anche altri organi interni, con il tempo compaiono segni che indicano un coinvolgimento dei reni: gonfiore sotto gli occhi, mal di schiena e problemi urinari. Possono verificarsi anche mal di testa persistenti, vertigini e perdita di sensibilità e movimento alle estremità a causa del coinvolgimento del cervello. In caso di endocardite infettiva si riscontra un rash maculare sulla congiuntiva degli occhi e sulla pelle si riscontrano piccole emorragie ed un rash maculopapulare.
Il decorso dell'endocardite infettiva può essere complicato dallo sviluppo di complicanze, molte delle quali pericolose per la vita: perforazione o separazione di parte della valvola e sviluppo di insufficienza cardiaca acuta, tromboembolia, ascessi del miocardio e dell'anello fibroso valvolare, glomerulonefrite e ipertensione polmonare.
Diagnostica

L'esame per sospetta EI comprende un esame dettagliato del paziente e un'auscultazione particolarmente attenta del cuore, vari esami del sangue, ECG ed ecografia del cuore (ecocardiografia). Un esame del sangue generale rivela segni tipici di infiammazione (aumento della VES, leucocitosi). È inoltre necessario coltivare il sangue venoso due volte per identificare l'agente patogeno specifico (questo richiede due campioni di sangue). Un risultato negativo dell’emocoltura, tuttavia, non esclude la diagnosi di EI. Un ruolo decisivo nella diagnosi è svolto dall'ecocardiografia (attraverso la parete toracica anteriore o transesofagea), con l'aiuto della quale è possibile determinare in modo affidabile la presenza di vegetazioni microbiche, il grado di danno alle valvole e i disturbi della funzione di pompaggio del cuore .
Trattamento
Il moderno programma di trattamento combinato per l'EI comprende terapia antibatterica, patogenetica e sintomatica, emocorrezione extracorporea e chirurgia cardiaca secondo le indicazioni. In ciascun caso, il trattamento viene selezionato individualmente. È necessario tenere conto del tipo di agente patogeno, della gravità delle condizioni del paziente, della fase di sviluppo e del decorso dell’EI e del volume delle misure di trattamento nelle fasi precedenti.
La terapia antibatterica per i pazienti con EI viene effettuata in ospedale nel rispetto dei principi di base:
- il trattamento dovrebbe essere etiotropico, mirato all'agente eziologico della malattia;
- Per il trattamento dovrebbero essere usati solo farmaci antibatterici con effetto battericida;
- la terapia per l'EI deve essere continua e a lungo termine: per l'infezione da streptococco - almeno 4 settimane;
- per l'infezione da stafilococco - almeno 6 settimane;
- per la flora gram-negativa – almeno 8 settimane;
- il trattamento dovrebbe includere la creazione di un'alta concentrazione di antibiotici nel letto vascolare e nelle vegetazioni (preferibilmente somministrazione di antibiotici per via endovenosa).
I criteri per interrompere il trattamento antibiotico dovrebbero essere una combinazione di diversi effetti:
- completa normalizzazione della temperatura corporea;
- normalizzazione dei parametri di laboratorio (scomparsa di leucocitosi, neutrofilia, anemia, chiara tendenza alla diminuzione della VES);
- risultati negativi degli esami del sangue batterici;
- scomparsa delle manifestazioni cliniche dell'attività della malattia.
Quando aumentano i segni di reazioni immunopatologiche (glomerulonefrite, artrite, miocardite, vasculite), è consigliabile utilizzare:
- glucocorticoidi (prednisolone non più di 15-20 mg al giorno);
- agenti antipiastrinici;
- plasma iperimmune;
- immunoglobulina umana;
- plasmaferesi.
Se il trattamento conservativo risulta inefficace entro 3-4 settimane, è indicata la chirurgia cardiaca. Nonostante la creazione negli ultimi anni di un gran numero di antibiotici e farmaci chemioterapici altamente efficaci, il trattamento dell’EI rimane un compito estremamente difficile. Ciò è dovuto alla crescente frequenza di inoculazione di ceppi patogeni altamente virulenti (stafilococco, Pseudomonas aeruginosa, microrganismi gram-negativi del gruppo NASEK), resistenti alla terapia antibatterica, alla diminuzione della resistenza immunologica della maggior parte dei pazienti, all'aumento della numero di pazienti anziani e senili e altri motivi. L’effetto della terapia antibatterica è in gran parte determinato dalla misura in cui la concentrazione di antibiotici creata nel sangue è sufficiente per agire sull’agente patogeno, che è localizzato in profondità nella fonte dell’infiammazione (vegetazione) e circondato da una barriera “protettiva” di trombina-fibrina. "coagulo.
Nel trattamento dell'EI vengono utilizzati antibiotici con effetto battericida: inibitori della sintesi della parete cellulare batterica - B-lattamici (penicilline, cefalosporine, carbopenemi); inibitori della sintesi proteica (aminoglicosidi, rifampicina); inibitori della sintesi degli acidi nucleici (fluorochinoloni). La Tabella 23 presenta i regimi di utilizzo degli antibiotici a seconda dell'agente patogeno e della sua sensibilità.
Caratteristiche della malattia

Con diverse varianti del decorso della malattia, alcune sindromi vengono alla ribalta nel quadro clinico. L'IE acuta corrisponde a una sindrome tossico-infettiva pronunciata, TEC, IE subacuta - sindrome da insufficienza cardiaca, TEC multipla, attacchi cardiaci, alterazioni autoimmuni. La variante protratta dell'EI è caratterizzata dalla sindrome da scompenso cardiaco e dal danno del complesso immunitario agli organi interni. Queste caratteristiche determinano il contenuto e la tattica della terapia.
Per trattare la sindrome infettiva-tossica, la terapia infusionale viene effettuata tenendo conto della gravità delle condizioni del paziente e della funzione escretoria dei reni. Soluzioni (soluzione salina al 5%, soluzione di glucosio al 10%, poliglucina, elettroliti), i diuretici vengono somministrati in quantità tali che la diuresi giornaliera supera di 300-400 ml il volume del liquido somministrato. Gli antipiretici sono prescritti per temperature corporee superiori a 380°C. Vengono utilizzate dosi terapeutiche medie di farmaci; nell'EI acuta e subacuta con manifestazioni pronunciate della sindrome, vengono utilizzate dosi massime.
Per ridurre l'intossicazione, ai pazienti con IE da stafilococco viene prescritto plasma da donatore anti-stafilococco secondo lo schema generalmente accettato. La durata della terapia è determinata dal tempo di eliminazione della sindrome o da una significativa riduzione delle sue manifestazioni. I criteri per un trattamento efficace sono: riduzione della temperatura corporea alla normalità, eliminazione dei brividi, riduzione della sudorazione, debolezza, malessere, normalizzazione degli indicatori di laboratorio dell'attività IE.
Nel trattamento dell'insufficienza cardiaca, è necessario tenere conto del fatto che nei pazienti con EI questa sindrome si sviluppa a causa di miocardite tossica infettiva, insufficienza della valvola cardiaca e una significativa diminuzione della contrattilità miocardica. Pertanto, è necessario effettuare contemporaneamente la stimolazione inotropa del miocardio, ridurre il digiuno e il precarico sul cuore e influenzare l'infiammazione e i processi autoimmuni nel miocardio.
Per raggiungere questi obiettivi vengono prescritti glicosidi cardiaci. Per stabilizzare la membrana cellulare, correggere l'infiammazione e il danno autoimmune ai miocardiociti, viene utilizzato il prednisolone (80-120 mg/die, parenterale). In caso di maggiore instabilità elettrica del miocardio e aumento dei sintomi di insufficienza cardiaca, vengono utilizzati farmaci con effetto inotropo positivo (dopamina, dopamina). Per scaricare il cuore: diuretici (ansa, tiazidici), inibitori dell'enzima di conversione dell'angiotensina (enalapril, captopril), vasodilatatori periferici (nitrati, idralazina).
Complicanze dell'endocardite infettiva

Le complicanze dell'endocardite infettiva con esito fatale sono shock settico, embolia cerebrale, cardiaca, sindrome da distress respiratorio, insufficienza cardiaca acuta e insufficienza multiorgano.
Con l'endocardite infettiva si osservano spesso complicanze degli organi interni:
- reni (sindrome nefrosica, infarto, insufficienza renale, glomerulonefrite diffusa)
- cuore (difetti della valvola cardiaca, miocardite, pericardite)
- polmoni (infarto, polmonite, ipertensione polmonare, ascesso)
- fegato (ascesso, epatite, cirrosi);
- milza (infarto, ascesso, splenomegalia, rottura)
- sistema nervoso (ictus, emiplegia, meningoencefalite, meningite, ascesso cerebrale)
- · vasi (aneurismi, vasculiti emorragiche, trombosi, tromboembolie, tromboflebiti).
Prevenzione
La prevenzione dell’endocardite infettiva dovrebbe essere effettuata principalmente nei soggetti ad aumentato rischio di sviluppare la malattia. Il rischio di malattia aumenta durante l'estrazione del dente, la rimozione di calcoli dentali, la tonsillectomia, la broncoscopia, la cistoscopia, l'adenomectomia, l'intervento chirurgico sulle vie biliari e sull'intestino.
Malattie in cui aumenta il rischio di sviluppare endocardite:
- Cardiopatia aortica
- HCM asimmetrico (stenosi subaortica)
- coartazione dell'aorta
- Sclerosi aortica con calcificazione
- rigurgito mitralico
- Prolasso della valvola mitrale con rigurgito
- pervietà del dotto arterioso
- storia di endocardite infettiva
- valvola artificiale
- difetti della valvola tricuspide
- Difetto IVS
- difetti della valvola polmonare
- Sindrome di Marfan
- protesi intracardiache non valvolari
- stenosi mitralica
- tromboendocardite
- aneurisma post-infarto
- pacemaker impiantati.
La batteriemia che si verifica in pazienti con le condizioni patologiche elencate è particolarmente spesso accompagnata dallo sviluppo di un'infiammazione infettiva dell'endocardio.
Per prevenire l'endocardite vengono utilizzati brevi cicli di terapia antibatterica:
- Impossibilità di assumere per via orale: ampicillina (2 g IV o IM) 30 minuti prima della procedura.
- Allergia alle penicilline: clindomicina (600 mg) o cefalexina/cefadroxil (2 g) o azotromicina/claritromicina (500 mg) per via orale 1 ora prima della procedura.
- Gruppo ad alto rischio: ampicillina (2 g IV o IM) in combinazione con gentamicina (1,5 mg/kg, ma non più di 120 mg, IV o IM) 30 minuti prima della procedura. Dopo 6 ore: ampicillina (1 g EV o IM) o amoxicillina (1 g per via orale).
- Gruppo ad alto rischio con allergia alla penicillina: vancomicina (1 g IV in 1-2 ore) in combinazione con gentamicina (1,5 mg/kg, ma non più di 120 mg, IV o IM); Completare la somministrazione 30 minuti prima della procedura.
- Gruppo a rischio moderato: amoxicillina (2 g per via orale) 1 ora prima della procedura o ampicillina (2 g IV o IM) 30 minuti prima della procedura.
- Gruppo a rischio moderato con allergia alla penicillina: vancomicina (1 g IV in 1-2 ore); introduzione.
L'uso profilattico degli antibiotici secondo questi regimi sembra prevenire un certo numero di casi di endocardite infettiva. Tuttavia, va ricordato che l'endocardite si verifica spesso in individui che non appartengono a gruppi ad alto rischio, nonché con batteriemia non associata alle procedure mediche elencate.
I cambiamenti più significativi nell’epidemiologia dell’endocardite infettiva si sono verificati negli ultimi 10-15 anni.
Se in passato l'EI colpiva spesso i giovani, nell'ultimo periodo si è verificato un netto aumento del numero di endocarditi infettive nelle fasce di età più anziane. Inoltre, la stragrande maggioranza di essi non presentava precedenti lesioni valvolari, ma spesso era stata sottoposta a procedure diagnostiche invasive. L'incidenza dell'endocardite infettiva dipende direttamente dalle condizioni sociali. Nei paesi in via di sviluppo, dove il ruolo dei reumatismi rimane elevato, l’EI è più comune nei giovani che negli anziani. Nei paesi sviluppati, l’incidenza è di 3-10 casi ogni 100.000 pazienti/anno, con 1,5-2,5 casi tra i giovani e 14,5 casi ogni 15.000 persone nelle fasce di età più anziane (70-80 anni).
La mortalità per endocardite infettiva è dell'11-27% durante il trattamento ospedaliero. Nel primo periodo post-ospedalizzazione la mortalità rimane molto elevata, raggiungendo il 18-40%.
Gli uomini si ammalano 2 volte più spesso delle donne.
Frequenza. L'endocardite infettiva si verifica con una frequenza dello 0,03-0,3%
Tipi di endocardite infettiva
È consuetudine distinguere 4 principi che costituiscono la base per determinare il tipo di endocardite infettiva:
- localizzazione dei processi; tipo di valvola (artificiale, naturale);
- luogo di insorgenza della malattia (ospedale, extraospedaliero, collegamento con la somministrazione del farmaco);
- attività di processo;
- endocardite infettiva ricorrente o reinfezione.
Cause di endocardite infettiva
L'endocardite infettiva acuta è spesso causata da batteri: Staphylococcus aureus, Streptococcus pyogenes, batteri Gram-negativi (Proteus, Pseudomonas aeruginosa, gruppo NASEK).
Nel corso di oltre un secolo di studi sulla diagnosi e sul trattamento dell'endocardite infettiva, è stato stabilito che quasi tutti i batteri possono causare la malattia. Tuttavia, solo i batteri che causano la batteriemia diventano particolarmente importanti: hanno la capacità di persistere a lungo nel flusso sanguigno, hanno una maggiore capacità di colonizzare l'endocardio e di formare un biofilm sulle superfici artificiali.
Queste capacità sono possedute principalmente da stafilococchi, streptococchi ed enterococchi. Questi microrganismi furono menzionati all'inizio della metà del XX secolo. e nelle ultime opere dell'inizio del XXI secolo. È stato accertato che la capacità di colonizzare l'endocardio è regolata dalla presenza di una proteina adesina sulla superficie del microrganismo. Tra le molte adesine, le più importanti sono quelle che legano il collagene, la fibrina e la fibronectina.
Pertanto, l'inizio della colonizzazione può essere descritto con il termine “aderenza”, che viene effettuato dalle adesine situate sulla superficie del batterio. Tuttavia, i microrganismi nel sangue sono necessari affinché si verifichi l’“adesione”. La fonte della batteriemia immediatamente precedente l'EI viene raramente identificata.
La fonte della batteriemia è stata identificata nel 48% dei pazienti con EI di valvole naturali e nel 41% dei pazienti con EI di valvole artificiali. Nei pazienti affetti da EI delle valvole naturali, la fonte dell'infezione è spesso la cavità orale. La patologia dentale è diventata la fonte della malattia nel 17% dei pazienti. Malattie della pelle, del sistema genito-urinario e del tratto gastrointestinale hanno portato a EI rispettivamente nell'8, 2 e 9% dei pazienti. Nei pazienti con endocardite infettiva delle valvole artificiali è stato osservato un quadro diverso. Molto spesso la fonte della batteriemia sono gli interventi medici (14% dei pazienti). Al secondo posto c'erano le malattie del sistema genito-urinario (11%) e le malattie del cavo orale - solo il 3%. Apparentemente, ciò è dovuto al fatto che il periodo preoperatorio prevede la sanificazione dei focolai di infezione.
La batteriemia transitoria è spesso causata dalla microflora tipica del cavo orale e dell'intestino. L'incidenza della batteriemia dopo interventi odontoiatrici varia dal 10 al 100%. Nella vita di tutti i giorni, la stragrande maggioranza delle persone sane può sperimentare una batteriemia da transito quando si lavano i denti. Gli esperti dell'American Heart Association hanno studiato paralleli clinici e batteriologici, ad es. è stata determinata la microflora più caratteristica che porta all'endocardite infettiva in pazienti con varie condizioni cliniche e malattie.
L'eziologia dell'EI nei pazienti con valvola artificiale dipende dal tempo trascorso dall'impianto della protesi. L'EI precoce è spesso causata da stafilococchi coagulasi-negativi (30-41%), Staph aureus (8-24%), batteri Gram-negativi - 10-15%, enterococchi - 3,3-10%, funghi - fino a 10 %, streptococco viridans - meno dell'1%.
L'endocardite infettiva tardiva provoca uno spettro di agenti patogeni vicino allo spettro dei patogeni naturali.
Le differenze nella flora nel periodo iniziale della malattia sembrano essere dovute al numero significativo di interventi medici e ai frequenti ricoveri ospedalieri.
La visione moderna della patogenesi determina le fasi: Fase 1 - penetrazione della flora dalla fonte dell'infezione nel flusso sanguigno e sviluppo di batteriemia persistente. Questa fase si verifica quando lo stato immunitario cambia. Fase 2: fissazione del microrganismo sulla superficie della valvola, endocardio. In questa fase, un ruolo importante spetta ai precedenti cambiamenti nella valvola, sia di natura organica che derivanti dall'effetto dannoso del flusso sanguigno, costretto a causa di difetti della valvola a muoversi a una velocità diversa e turbolenta, il che crea tutte le condizioni per l’introduzione dei batteri nell’endocardio. Possono verificarsi danni ai lembi valvolari a causa di danni meccanici agli elettrodi del pacemaker o processi degenerativi causati da cambiamenti legati all'età. Alterazioni degenerative dei lembi valvolari vengono rilevate nel 50% dei pazienti di età superiore ai 60 anni senza quadro clinico di endocardite infettiva. Stadio 3 - cambiamenti iniziali nella valvola - segni locali di infiammazione: gonfiore, essudazione, ecc. Stadio 4 - la formazione di complessi immunitari (produzione di autoanticorpi contro la struttura tissutale alterata), che si depositano in vari organi e causano la natura sistemica della malattia: danni al cuore, ai reni, al fegato, ai vasi sanguigni.
La patogenesi dell'endocardite infettiva è caratterizzata dalle seguenti sindromi.
- Sindrome da intossicazione. A partire dal 1o stadio della malattia, i batteri nel corpo del paziente provocano intossicazione, manifestata da debolezza, febbre, aumento della VES, leucocitosi e altre manifestazioni tipiche dell'intossicazione.
- L'aumento della massa batterica, da un lato, mantiene stabilmente la gravità dell'intossicazione, dall'altro favorisce la crescita della vegetazione sulle valvole; la crescita delle vegetazioni porta al distacco dei loro frammenti e alla sindrome embolica.
- Gli emboli settici contribuiscono alla generalizzazione del processo e all'introduzione dell'infezione in quasi tutti gli organi. Un embolo provoca l'occlusione meccanica di un vaso, che porta all'interruzione regionale del flusso sanguigno (accidente cerebrovascolare acuto (ACVA), infarto miocardico embolico, infarto renale, danno retinico embolico, ecc.).
- Sindrome autoimmune. Gli immunocomplessi circolanti causano vasculite, polisierosite, glomerulonefrite, capillarite ed epatite.
- Sindrome da insufficienza multiorgano. Innanzitutto, l’insufficienza renale terminale e l’insufficienza cardiaca acuta sono le principali cause di morte nell’EI.
Sintomi dell'insorgenza della malattia
Le manifestazioni dell'endocardite infettiva all'esordio della malattia sono varie e dipendono sia da precedenti alterazioni delle valvole, sia dal tipo di microrganismo che ha causato la malattia.
L'endocardite infettiva esordisce con il quadro clinico di una malattia infettiva acuta, accompagnata da febbre, grave intossicazione, danno multiorgano e insufficienza circolatoria rapida. Allo stesso modo, l'esordio della malattia si manifesta con una leggera febbre e sintomi inespressi, che complicano la diagnosi della malattia. In una situazione del genere, un paziente che lamenta debolezza e perdita di peso fa un lungo viaggio verso medici di diverse specialità finché non diventa evidente la comparsa di cambiamenti specifici nelle valvole. Oltre il 90% dei pazienti riferisce febbre, debolezza, perdita di appetito, perdita di peso, sudorazione, mialgia.Nell'85% dei pazienti nelle prime fasi della malattia compare un rumore caratteristico dell'insufficienza mitralica, aortica o tricuspide.
Emorragie tipiche, glomerulonefrite ed epatosplenomegalia si notano in circa il 30% dei pazienti con EI. Circa un terzo dei pazienti sviluppa una sindrome embolica di varia gravità. La complessità del quadro clinico dell'insorgenza della malattia impone al medico di assumere una possibile IE nelle seguenti situazioni.
- La comparsa di “nuovi” rumori nell'immagine dell'auscultazione del cuore. Modificazione dello schema auscultatorio di un difetto cardiaco preesistente.
- La comparsa di embolia in assenza di un'evidente fonte di emboli.
- La comparsa di febbre in un paziente con una valvola artificiale installata con un pacemaker.
- La comparsa di febbre in un paziente precedentemente trattato per endocardite infettiva.
- La comparsa di febbre in un paziente con cardiopatia congenita.
- La comparsa di febbre in un paziente con immunodeficienza.
- La comparsa di febbre dopo procedure che predispongono alla batteriemia.
- La comparsa di febbre in un paziente affetto da insufficienza cardiaca congestizia.
- La comparsa di febbre in un paziente con noduli di Osler, emorragie, embolia.
- La comparsa della febbre sullo sfondo della sindrome epatolienale.
La manifestazione dell'EI si manifesta con una serie di sintomi tipici; La loro identificazione nei pazienti consente di ottimizzare la diagnosi.
Il più tipico per l'endocardite infettiva:
- sindrome infiammatoria sistemica: febbre, brividi, sudorazione notturna, leucocitosi con spostamento a sinistra, anemia, emocolture positive;
- sindrome da intossicazione: debolezza, perdita di appetito, mialgia, artralgia, perdita di peso;
- sindrome emodinamica: formazione di cardiopatia valvolare con valvole precedentemente invariate e formazione di malattia valvolare combinata;
- sindrome autoimmune: glomerulonefrite, miocardite, epatite, vasculite;
- sindrome tromboembolica: embolia nel cervello, intestino, milza, rene, retina.
La manifestazione della malattia è regolata dal tipo di agente patogeno. Pertanto, l'EI stafilococcica è caratterizzata da intossicazione significativa, febbre frenetica, grave gravità della condizione e rapida comparsa di "dropouts" - embolia settica; L'endocardite infettiva fungina è caratterizzata dall'occlusione delle grandi arterie. Un quadro tipico dell'endocardite infettiva, descritto da W. Osler all'inizio del 20° secolo. caratteristico dello streptococco viridans.
La conclusione principale dell'analisi del quadro clinico dell'insorgenza della malattia è un'ampia gamma di sintomi e sindromi, che non possono essere algoritmizzati nemmeno all'inizio del 21° secolo. La sua interpretazione richiede un'elevata professionalità del medico.
Valore prognostico dei sintomi clinici di esordio della malattia
La mortalità ospedaliera nei pazienti con EI varia dal 9,6 al 26%. Il tasso di mortalità estremamente elevato anche nell'era del trattamento antibatterico e dell'intervento chirurgico precoce richiede l'introduzione nella pratica quotidiana di una valutazione prognostica preliminare dei sintomi dell'insorgenza della malattia. Ciò consentirà di ottimizzare il trattamento della malattia, ad esempio, considerando il trattamento chirurgico come quello principale già all'esordio della malattia. La valutazione prognostica dei sintomi si basa su 4 fattori: ritratto clinico del paziente; manifestazioni extracardiache della malattia; caratteristiche dell'agente patogeno; risultati dell'ecocardiografia. La prognosi è sempre peggiore quando l'endocardite infettiva è localizzata sulle valvole del cuore “sinistro”, e un paziente con insufficienza circolatoria in rapida progressione, glomerulonefrite e flora accertata di S. aureus ha un alto rischio di morte e richiede un trattamento chirurgico il più presto possibile. fasi della malattia. Il rischio di morte in questi pazienti raggiunge il 79%. Bassi livelli di EF o il loro rapido declino in breve tempo, diabete mellito, accidente cerebrovascolare (possibile embolia in altri organi) aumentano il rischio di morte di oltre il 50%. Pertanto, nelle moderne tattiche di gestione dei pazienti, il principio della valutazione prognostica precoce delle condizioni dei pazienti è stato chiaramente formulato per formare un gruppo di pazienti che necessitano del trattamento chirurgico il più presto possibile.
La presenza di almeno uno dei sintomi è sufficiente per valutare la prognosi del paziente come severa.
Sintomi nel periodo post-debutto
Uno dei sintomi più comuni della malattia è la febbre. Il grado di aumento della temperatura corporea varia. Con l'esordio acuto della malattia, di regola, la febbre raggiunge un livello elevato e la differenza tra la temperatura corporea massima e minima può raggiungere 2-3 ° C. Con l'inizio subacuto della malattia, la temperatura è di basso grado. Nei pazienti indeboliti potrebbe non esserci febbre. L'assenza di febbre è considerata un indicatore prognostico di malattia grave. Nei casi più gravi, la febbre è accompagnata da brividi e sudorazione profusa. Nella maggior parte dei casi, l’aumento della temperatura avviene durante la notte, il che porta il paziente a “sudare”.
Insieme alla febbre compaiono sintomi caratteristici dell'insufficienza circolatoria: mancanza di respiro, tachicardia. La base dell'insufficienza circolatoria non è solo l'alterata emodinamica intracardiaca causata dalla distruzione della valvola, ma anche lo sviluppo di miocardite. La combinazione di miocardite e distruzione dei lembi valvolari porta alla rapida formazione di rimodellamento delle camere cardiache. Durante questo periodo, il medico che ascolta regolarmente il cuore, oltre ai caratteristici soffi, determina una diminuzione del volume del primo tono al 1° punto di auscultazione. Questo si riferisce a segni di una prognosi difficile. Durante questo stesso periodo, il colore della pelle può cambiare. S.P. Botkin, W. Osler descrisse questo colore come il colore del caffè con il latte e gli attribuì grande importanza. Nelle cliniche moderne, questo sintomo ha perso il suo significato e non è nemmeno menzionato nei manuali come importante dal punto di vista diagnostico.
Ogni paziente nota artralgia e mialgia. Il dolore è sistemico e solitamente simmetrico. Il dolore locale è atipico e richiede l'esclusione dell'embolia o dell'insorgenza di osteomielite.
Un paziente su tre mostra chiaramente segni di rapida perdita di peso. Questo è un sintomo importante che riflette il grado di intossicazione e la gravità della prognosi. Le osservazioni di pazienti con endocardite infettiva hanno dimostrato che l'eccesso di tessuto adiposo prima della malattia è associato al numero di decessi.
Un paziente su sette riferisce mal di testa e aumento della pressione sanguigna. Il suo aumento si basa sullo sviluppo di glomerulonefrite, che è accompagnato da proteinuria, diminuzione della velocità di filtrazione glomerulare e aumento dei livelli di creatinina. Il monitoraggio della velocità di filtrazione glomerulare è obbligatorio per tutti i pazienti con endocardite infettiva, poiché consente un calcolo adeguato delle dosi di antibiotici somministrati. Durante il periodo di un quadro clinico dettagliato, il medico si aspetta tradizionalmente di rilevare manifestazioni caratteristiche della malattia nella periferia: nodi di Osler, macchie di Roth, emorragie del letto ungueale, macchie di Janeway. Queste stimmate della malattia erano di grande importanza nell'era pre-antibatterica, ma nelle cliniche moderne si incontrano raramente, la loro frequenza<5%.
S.P. Botkin attribuiva grande importanza alla palpazione della milza, identificando diversi tipi di densità del suo bordo, che consentono di valutare la gravità della malattia. Nell'era del trattamento dell'EI con antibiotici, la splenomegalia grave può essere osservata in meno del 5% dei pazienti.
Pertanto, il quadro clinico dell’endocardite infettiva è cambiato in modo significativo. La clinica è dominata da un'alta frequenza di forme cancellate, sindrome da intossicazione, sindrome da lesioni autoimmuni e sindrome da disturbi emodinamici. Non ci sono praticamente sintomi di shock.
Con un farmaco antibatterico adeguatamente selezionato, la febbre può essere fermata prima del 7-10° giorno. La persistenza della febbre per un lungo periodo di tempo indica la presenza dell'agente infettivo S. aureus o l'aggiunta di un'infezione nosocomiale (secondaria) o la presenza di un ascesso.
La normalizzazione della temperatura non significa che il paziente sia guarito. In molti modi, il quadro clinico del periodo successivo all'esordio della malattia è costituito da complicanze della malattia. Le complicanze tipiche dell'endocardite infettiva sono l'insufficienza circolatoria, il processo infettivo incontrollato (ascesso, aneurisma, fistola, crescita della vegetazione, persistenza della temperatura per >7-10 giorni), embolia, manifestazioni neurologiche, insufficienza renale acuta. Una complicazione si osserva nel 70% dei pazienti, due complicazioni contemporaneamente - nel 25% dei pazienti.
Nei tossicodipendenti, la valvola tricuspide è più spesso colpita con lo sviluppo di tromboembolia settica nei vasi del piccolo circolo (infarto-polmonite bilaterale multiplo con disintegrazione).
Trattamento dell'endocardite infettiva
Trattamento antimicrobico
Questo trattamento è il cardine del trattamento per l’endocardite infettiva. Sono stati gli antibiotici a trasformare l'EI da una malattia mortale assolutamente incurabile in una malattia curabile. Negli ultimi decenni si sono verificati sviluppi significativi nello studio della flora che causa l’EI, che hanno permesso di formulare le principali tendenze nel moderno trattamento antibatterico dell’endocardite infettiva.
- Ovunque si è osservata una crescente resistenza degli agenti patogeni agli antibiotici utilizzati e un aumento del numero di ceppi di stafilococchi resistenti all'oxacillina. Ad esempio, nella Federazione Russa la frequenza dello S. aureus resistente all'oxacillina è del 33,5%. La stessa cifra negli USA è raddoppiata in 5 anni. Dal 2002 al 2007, l’incidenza degli enterococchi resistenti alla vancomicina è aumentata dal 4,5 al 10,2%. La tendenza generale è la registrazione diffusa di ceppi multiresistenti di stafilococco, enterococco, pneumococco e altri microrganismi. Ciò ha portato ad una diminuzione dell’efficacia dei tradizionali regimi di trattamento antibatterico per l’endocardite infettiva.
- È stata dimostrata la sopravvivenza della microflora dopo il trattamento antibatterico nella vegetazione e nei film batterici che ricoprono la valvola artificiale. I batteri in essi contenuti sono praticamente protetti dai farmaci antibatterici. Gli esperti vedono una soluzione a questo problema nell'aumento della durata del trattamento da 2 a 4-6 settimane per l'EI delle valvole native e fino a 6 mesi per l'EI delle valvole protesiche.
- Viene sottolineato l'uso precoce di un regime combinato di farmaci antibatterici, che deve essere discusso in tutti i casi di febbre persistente durante il trattamento antibatterico.
- Viene sottolineata l'organizzazione capillare di servizi microbiologici di alta qualità, che consente di scegliere il trattamento antibatterico su base eziologica il più precocemente possibile nel decorso della malattia. È molte volte più efficace del trattamento antibiotico empirico per l’EI con un agente patogeno sconosciuto.
- Nei casi gravi di endocardite infettiva, la combinazione più efficace di trattamento antibatterico e chirurgico seguita dalla correzione del regime di trattamento antibatterico basato sulla PCR di materiale proveniente da vegetazioni ed emboli.
Il trattamento dell’endocardite infettiva con antibiotici è diviso in due approcci fondamentalmente diversi. A - trattamento dell'EI con un patogeno identificato e B - trattamento dell'EI con un patogeno sconosciuto.
Trattamento dell'endocardite infettiva con un agente patogeno accertato
Endocardite infettiva streptococcica
Streptococchi sensibili alla penicillina
La tattica per la scelta di un regime antibiotico dipende dal valore della concentrazione minima inibente (MIC). Se l'IPC<0,125 мг/л (в 90% случаев неосложненного течения инфекционного эндокардита), то двухнедельное лечение пенициллином в комбинации с цефтриаксоном или гентамицином (или нетимицином) оптимально. Назначая аминогликозиды (гентамицин, нетимицин), следует удостовериться, что функция почек сохранена. При умеренном снижении их функции или исходно нормальных показателях можно обсуждать режим использования гентамицина 1 раз в день. Больным с аллергией на?-лактамные антибиотики показан ванкомицин.
L’antibiotico teicoplanina, ampiamente discusso, non ha prove convincenti di efficacia.
Streptococchi resistenti alla penicillina
Se MIC >0,125 mg/l, ma<2,0 мг/л, то стрептококки относительно резистентны. Если МПК >2,0 mg/l, allora questo ceppo è considerato assolutamente resistente. In numerose raccomandazioni, i ceppi sono considerati assolutamente resistenti se la MIC è >0,5 mg/l. Recentemente si è notato un aumento significativo dei ceppi assolutamente resistenti alle penicilline, superiore al 30%. Il quadro clinico di tale endocardite infettiva è caratterizzato da gravità, la mortalità è del 17%. Nonostante gli antibiotici di base comuni nel trattamento dei ceppi penicillino-resistenti e sensibili alla penicillina dell’EI, la durata del trattamento e la combinazione di farmaci antibatterici differiscono. È escluso un regime di trattamento breve. La durata del trattamento aumenta da 2 settimane per i ceppi penicillina-sensibili a 4 settimane per i ceppi penicillino-resistenti. Con una MIC elevata, la vancomicina diventa il farmaco di scelta. Qualsiasi forma di resistenza (relativa o assoluta) implica una durata del trattamento con aminoglicosidi fino a 4 settimane insieme ai farmaci di base.
L'endocardite infettiva causata da questi agenti patogeni è relativamente rara nelle cliniche moderne. Data l'elevata incidenza della meningite (caratteristica della polmonite da streptococco), è importante determinare come trattare l'endocardite infettiva, se è associata o meno alla meningite. Nei casi in cui la meningite è assente, le tattiche di trattamento sono determinate a livello MIC (ceppo sensibile, relativamente sensibile, resistente). In combinazione con la meningite, la penicillina deve essere esclusa a causa della sua scarsa capacità di penetrare nel liquido cerebrospinale.
Il farmaco d’elezione in questa situazione è il ceftriaxone.
Gli streptococchi P-emolitici hanno una serie di caratteristiche:
- il gruppo A è caratterizzato da un decorso relativamente lieve della malattia e, di regola, è rappresentato da ceppi sensibili alla penicillina;
- il gruppo B ha cominciato ad essere identificato nei pazienti recentemente;
- I microrganismi dei gruppi B, C e G sono caratterizzati da un'elevata incidenza di sviluppo di ascessi. A questo proposito, la questione del trattamento chirurgico deve essere decisa fin dai primi giorni della malattia.
Per tutti i gruppi, la scelta del regime streptococcico dipende dalla MIC. Il regime di trattamento a breve termine è strettamente controindicato.
Endocardite infettiva causata da stafilococco
L'endocardite infettiva causata da S. aureus è caratterizzata da un decorso grave e da una rapida distruzione della valvola. L'EI causata da ceppi coagulasi-negativi è caratterizzata dalla formazione di un ascesso perivalvolare e da complicanze settiche metastatiche. Se viene verificata la flora stafilococcica, la durata del trattamento dovrebbe superare le 4 settimane e raggiungere le 6 settimane.
Quando si identifica la flora stafilococcica, la questione più importante per il medico diventa la questione della sensibilità della flora alla meticillina. La flora resistente alla meticillina è caratterizzata da malattie gravi e mortalità elevata. Il farmaco principale, quello di scelta nel trattamento dell’EI da stafilococco, è l’oxacillina. L'elevata efficacia dell'oxacillina è stata dimostrata per l'EI da stafilococco del cuore sinistro delle valvole native con un decorso senza complicazioni per una durata di trattamento di 4 settimane, per le complicanze dell'endocardite infettiva, una durata di trattamento di 6 settimane. Per l'endocardite infettiva da stafilococco delle valvole cardiache destre con un decorso semplice, si raccomanda un ciclo di trattamento di 2 settimane. In clinica non esistono prove convincenti dell'efficacia clinica della gentamicina per l'EI da stafilococco, tuttavia, la posizione concordata degli esperti consente di aggiungere la gentamicina al trattamento con oxacillina per 3-5 giorni per l'EI delle valvole naturali e fino a 2 settimane per l'IE delle valvole protesiche.
L'inclusione della rifampicina nel trattamento antibatterico combinato dell'endocardite infettiva è dovuta al fatto che la rifampicina è altamente efficace contro le pellicole batteriche che ricoprono le superfici metalliche di pacemaker e valvole artificiali. Nei pazienti con una reazione allergica alla penicillina (non una reazione di tipo anafilattico), sono possibili le cefalosporine di 4a generazione. In caso di reazione anafilattica alla penicillina è possibile solo la vancomicina con gentamicina.
I pazienti con stafilococchi resistenti alla meticillina e alla vancomicina hanno formato una nicchia speciale nel trattamento dell'endocardite infettiva. Il monitoraggio della flora nei pazienti affetti da EI mostra che negli ultimi 3-5 anni il livello di resistenza è aumentato rapidamente. Per la resistenza alla meticillina il farmaco di scelta è la vancomicina. La prescrizione di altri gruppi (in pratica in queste situazioni vengono prescritti i carbapenemi) è errata, perché L'MRSA è resistente ad essi. La prognosi di un paziente con EI causata da ceppi resistenti alla vancomicina è grave. In questa situazione è possibile utilizzare menesolid. Sono allo studio il ruolo di un nuovo antibiotico, la quinupristina, la dalfopristina (Sinertsit), e di un nuovo lipopeptide ciclico, la daptomicina (6 mg/kg al giorno per via endovenosa). In tutti i casi di resistenza alla vancomicina, il paziente deve essere gestito insieme a un farmacologo clinico.
In caso di EI di una valvola protesica, il medico deve determinare con precisione la data dell'intervento. Se l'endocardite infettiva da stafilococco si è sviluppata prima di 1 anno di età, è stata causata da stafilococco coagulasi-negativo resistente alla meticillina. In questa situazione, la combinazione di vancomicina con rifampicina e gentamicina per 6 settimane è ottimale. Se il ceppo è resistente alla gentamicina o ad altri aminoglicosidi, è necessario aggiungere un fluorochinolone al posto dell'aminoglicoside alla combinazione di tre antibiotici.
Endocardite infettiva causata da enterococchi
L'endocardite infettiva enterococcica è causata nel 90% dei casi da Enterococcus faecalis e molto meno spesso da E. faecium. Entrambi i ceppi sono caratterizzati da una sensibilità estremamente bassa agli antibiotici, che ovviamente richiede un trattamento adeguato fino a 6 settimane e una combinazione obbligatoria di farmaci antibatterici basata sul sinergismo dell'attività battericida delle penicilline, della vancomicina con gli aminoglicosidi. L'essenza di questa combinazione è che le penicilline e la vancomicina aumentano la permeabilità della membrana enterococchiale agli aminoglicosidi. L'aumento della permeabilità porta alla creazione di un'alta concentrazione di farmaci nei ribosomi all'interno della cellula, che porta ad un pronunciato effetto battericida. Le linee guida statunitensi (AHA) ed europee differiscono sulla scelta del primo farmaco nel trattamento dell'endocardite infettiva enterococcica. Negli Stati Uniti si consiglia la dose di penicillina fino a 30 milioni di unità/giorno. Nelle raccomandazioni europee il farmaco di scelta è l’amoxicillina, 200 mg/kg al giorno, per via endovenosa, o l’ampicillina alla stessa dose. Il secondo farmaco di scelta per il trattamento combinato è la gentamicina. Se la flora è resistente alla gentamicina, questa deve essere sostituita con streptomicina alla dose di 15 mg/kg al giorno per via endovenosa o intramuscolare ogni 12 ore; è necessario il monitoraggio della funzionalità renale. L'eliminazione della flora enterococcica è efficace solo con una combinazione di penicilline e aminoglicosidi.
In un certo numero di pazienti si nota resistenza alla serie delle penicilline; in queste situazioni, il farmaco penicillinico viene sostituito con vancomicina. Se il ceppo di Enterococchi è multiresistente, anche alla vancomicina, è consigliabile iniziare il trattamento con minezolid, 1200 mg/die, per via endovenosa, in 2 dosi.
I seguenti punti sono importanti per la pratica:
- Solo due aminoglicosidi - gentamicina e streptomicina - hanno un effetto sinergico con le penicilline; altri aminoglicosidi non hanno tale effetto;
- se l'endocardite infettiva enterococcica è causata da E. faecalis resistente alla penicillina, alla vancomicina e agli aminoglicosidi, la durata del trattamento deve superare le 8 settimane;
- è possibile una combinazione di due antibiotici β-lattamici: ampicillina con ceftriaxone o carbopenem (glipenem) con ampicillina. Tuttavia, questa esperienza è stata poco studiata, classe di evidenza 2C.
Endocardite infettiva dovuta al gruppo HASEK
Un certo numero di microrganismi gram-negativi sono combinati nel gruppo NASEK. In totale, questi microrganismi causano dal 5 al 10% di tutti i casi di endocardite infettiva delle valvole naturali. Una caratteristica distintiva del NASEK è la sua crescita lenta, che rende difficile determinare la concentrazione minima inibente. Numerosi microrganismi del gruppo HASEK secernono p-lattamasi, il che rende difficile l'uso delle penicilline non protette come farmaci di prima scelta. È stata dimostrata l'efficacia del ceftriaxone alla dose di 2 mg al giorno per 4 settimane.
Per i ceppi che non producono β-lattamasi è stata dimostrata l'efficacia dell'ampicillina, 12 g al giorno, per via endovenosa in 4-6 dosi, più gentamicina, 3 mg/kg al giorno, in 2 o 3 dosi. Durata del trattamento - 4 settimane.
L'efficacia del fluorochinolone ciprofloxacina, 400 mg, per via endovenosa 2 volte al giorno, sull'HASEC è inferiore a quella della combinazione aminopenicillina + aminoglicoside.
Nel 2007, l’International Infectious Endocarditis Study Group ha segnalato EI causata da flora Gram-negativa non NASEC. Tale IE è stata rilevata in 49 (8%) dei 276 pazienti con IE inclusi nel registro. La gravità della malattia consente ai ricercatori di raccomandare il trattamento chirurgico il prima possibile + trattamento con antibiotici p-lattamici insieme a aminoglicosidi.
Endocardite infettiva causata da agenti patogeni rari
Nella stragrande maggioranza dei casi, gli agenti patogeni rari non vengono rilevati con i metodi convenzionali e il paziente rientra nella categoria delle endocarditi infettive con un agente patogeno sconosciuto. Negli ultimi anni i microrganismi sono stati classificati come tali patogeni. Nonostante la loro rarità, è obbligatorio uno studio batteriologico speciale dopo i risultati dell'emocoltura negativa.
La durata dell'endocardite infettiva causata da rare forme di microrganismi non è stata stabilita. I farmaci batteriostatici doxiciclina ed eritromicina sono utilizzati nel trattamento dell'endocardite infettiva solo in questa situazione.
Trattamento empirico
Quando la flora che causa l'endocardite infettiva non può essere identificata, o l'analisi microbiologica non è possibile, o il paziente è in attesa dei risultati di laboratorio, il medico deve determinare la scelta del farmaco antibatterico. Quando si prende una decisione, è necessario sapere se esiste una protesi valvolare, quando è stata installata, se il paziente ha ricevuto in precedenza (quando) un trattamento antibatterico (cosa), se c'è un'intolleranza agli antibiotici p-lattamici.
In queste situazioni si consiglia di iniziare il trattamento con ampicillina-sulbactam, 12 g/die, in associazione con gentamicina. Se la penicillina è intollerante, la vancomicina viene prescritta in combinazione con ciprofloxacina e gentamicina. Per l’IE della valvola protesica, è efficace una combinazione di vancomicina con rifampicina e gentamicina. È consigliabile aggiungere cefipime a questa combinazione se le protesi sono state eseguite 2 mesi prima della malattia e la probabilità dell'aggiunta di aerobi gram-negativi è alta.
Prevenzione dell'endocardite infettiva
Innanzitutto la prevenzione dell'endocardite infettiva deve essere effettuata nei pazienti con valvole alterate, cioè con difetti cardiaci, indipendentemente dal fatto che siano stati operati o meno.
Come misura di prima priorità, i focolai di infezione di qualsiasi luogo vengono disinfettati. Durante l'estrazione del dente, la tonsillectomia, l'installazione di un catetere urinario e la sua rimozione, qualsiasi operazione urologica, fibrogastroscopia, colonscopia, brevi cicli di antibiotici devono essere utilizzati a scopo profilattico. Se si accerta che un paziente è intollerante ai farmaci penicillinici, viene utilizzata l'amoxicillina, 2 g 1 ora prima dell'intervento (l'ampicillina è possibile). In caso di intolleranza alle aminopenicilline vengono utilizzati i macrolidi.
Per interventi nella zona urogenitale, fibrocolonscopia, gastroscopia in pazienti ad alto rischio di endocardite infettiva, è consigliabile un trattamento profilattico con una combinazione di farmaci: ampicillina, 2,0 g e.v. + gentamicina, 1,5 mg/kg e.v. un'ora prima dell'intervento e un'ora prima dell'intervento. un'ora dopo la procedura, somministrare ampicillina per via orale, 2,0 g Nei pazienti a rischio moderato ci si può limitare a utilizzare questa combinazione solo prima dell'intervento. In caso di intolleranza alle aminopenicilline, in pazienti ad alto e moderato rischio, è consigliabile somministrarla e aggiungere la vancomicina al regime terapeutico 1-2 ore prima dell'intervento.
Sopravvivenza e mortalità dei pazienti con endocardite infettiva
Il tasso di sopravvivenza a 10 anni è del 60-90%; Il 50% dei pazienti guariti sopravvive oltre i 20 anni. La sopravvivenza dipende da una serie di fattori. È più elevato quando la malattia esordisce più precocemente, nei pazienti sottoposti a trattamento chirurgico. L'elevata mortalità a lungo termine è associata alla NC.
- Valuta il materiale
Nuovi articoli
Efficace: corticosteroidi topici. Si presuppone che l'efficacia sia: controllo degli acari della polvere domestica. Efficacia non dimostrata: interventi dietetici; allattamento al seno a lungo termine nei bambini inclini all’atopia. andare
Raccomandazioni dell'OMS per la prevenzione terziaria delle allergie e delle malattie allergiche: - i prodotti contenenti latte sono esclusi dalla dieta dei bambini con accertata allergia alle proteine del latte vaccino. Durante l'alimentazione supplementare vengono utilizzate miscele ipoallergeniche (se sì, vai
La sensibilizzazione allergica in un bambino affetto da dermatite atopica è confermata da un esame allergologico, che identificherà gli allergeni causalmente significativi e adotterà misure per ridurre il contatto con essi. Nei bambini. andare
Nei neonati con una storia familiare di atopia, l’esposizione agli allergeni gioca un ruolo critico nella manifestazione fenotipica della dermatite atopica e pertanto l’eliminazione degli allergeni a questa età può portare ad una riduzione del rischio di sviluppare allergeni. andare
La moderna classificazione della prevenzione della dermatite atopica è simile ai livelli di prevenzione dell'asma bronchiale e comprende: prevenzione primaria, secondaria e terziaria. Poiché le cause della dermatite atopica non sono aggiornate. andare
Sintomi e trattamento dell'endocardite infettiva

Confronto delle valvole nella malattia
Il nostro cuore è un organo importante e molto complesso, soggetto abbastanza facilmente a cambiamenti, purtroppo di natura negativa. Uno di questi cambiamenti è l’endocardite infettiva. E una malattia in cui l'infiammazione si verifica nel rivestimento interno del cuore. Questo rivestimento interno, cioè il tessuto connettivo, riveste le valvole e le cavità del cuore. Il decorso di questa malattia aiuta a comprendere le ragioni della sua insorgenza.
Cause
Il nome di questa malattia riflette bene l'essenza del processo patologico, perché la malattia può essere causata da vari agenti infettivi.
- Stafilococchi. Oggi è sempre più possibile riscontrare un'endocardite di tipo infettivo causata dallo stafilococco. Di solito il suo decorso è il più grave rispetto ad altri agenti patogeni. Inoltre, il suo decorso è di natura nosocomiale, cioè questo tipo di malattia si verifica spesso quando i cateteri vascolari, le fistole e i nodi artero-venosi si infettano.

Streptococchi
Streptococchi. Endocardite infettiva, causata da Str. Viridaris, caratterizzato da un esordio graduale e lento. Ciò spesso comporta valvole modificate. Endocardite causata da Str. Boyis. Di solito si sviluppa sullo sfondo della patologia gastrointestinale e, più specificamente, si tratta di poliposi intestinale, cancro del colon o dello stomaco, ulcera duodenale o gastrica. Se l'agente eziologico è lo streptococco β-emolitico, molto probabilmente il paziente soffre di diabete mellito o di un'altra malattia cardiaca. Il decorso di questa forma è solitamente grave.

Pseudomonas aeruginosa
Pseudomonas aeruginosa. Questo agente patogeno colpisce le valvole precedentemente modificate e intatte situate sia sul lato destro che su quello sinistro del cuore. La malattia causata da Pseudomonas aeruginosa è grave e difficile da trattare.
La classificazione dell'endocardite infettiva comprende anche la differenziazione della malattia in base a diversi fattori. Esistono due forme cliniche e morfologiche di endocardite infettiva.
- Forma primaria. Si verifica in condizioni settiche che hanno diverse eziologie. La lesione di solito colpisce le valvole cardiache inalterate.
- Forma secondaria. Si sviluppa sullo sfondo di patologie già presenti nelle valvole o nei vasi, nonché in malattie come la sifilide e i reumatismi. La forma secondaria può comparire dopo la sostituzione della valvola.
Secondo il decorso clinico, l'endocardite infettiva è divisa in tre tipi.
- Corso acuto. Durata: due mesi. È una conseguenza di manipolazioni mediche sulle cavità del cuore o dei vasi sanguigni o di una condizione settica acuta.
- Decorso subacuto. La durata è superiore ai due mesi. Si verifica perché il trattamento della forma acuta è stato inefficace e insufficiente.
- Flusso prolungato.
Sintomi
I sintomi dell’endocardite infettiva dipendono da fattori quali l’età del paziente, da quanto tempo è presente la malattia e la forma della malattia. Inoltre, le manifestazioni possono dipendere dalla precedente terapia antibiotica.

I sintomi della malattia possono includere mancanza di respiro, debolezza, affaticamento
Le manifestazioni cliniche sono causate da tossinemia e batteriemia. In generale, i pazienti lamentano mancanza di respiro, debolezza, affaticamento, perdita di peso, perdita di appetito e febbre. C'è pallore della pelle, piccole emorragie nella zona delle clavicole, sulla mucosa della bocca, sulla congiuntiva degli occhi e in altri luoghi. Se si verifica un lieve trauma alla pelle, viene rilevato un danno capillare. Questa condizione è anche chiamata sintomo del pizzicotto. Vale la pena prestare attenzione alla forma delle unghie e delle dita. Le unghie diventano come vetri di orologio e le dita come bacchette.
In molti pazienti, l'endocardite è accompagnata da danni al muscolo cardiaco e soffi funzionali associati a danno valvolare e anemia. Se i lembi delle valvole aortica e mitrale sono danneggiati, si osserveranno segni di insufficienza. Possono verificarsi angina e sfregamento pericardico.
Nel sottotitolo precedente abbiamo discusso gli agenti causali dell'endocardite. È importante capire che ognuno di essi, iniziando ad agire nel corpo del paziente, si manifesta con sintomi individuali. Comprenderlo aiuta a determinare con maggiore precisione la forma della malattia. Diamo un'occhiata ad alcuni agenti patogeni, ma ora dal lato dei segni che sono inerenti ad essi.

Stafilococco
Stafilococchi. Il processo che provocano è piuttosto attivo. Si osserva febbre frenetica, accompagnata da sudorazioni abbondanti. Compaiono molti focolai di infezione metastatica. Eruzione cutanea emorragica, suppurazione, eruzione cutanea e necrosi si sviluppano ampiamente. Potrebbero verificarsi danni al cervello. C'è un leggero ingrossamento della milza. Questo, oltre alla sua consistenza morbida, lo rende difficile da sentire. Nonostante ciò, spesso si verificano rotture spleniche e infarti settici. L’endocardite si sviluppa spesso nella parte sinistra del cuore, dove le valvole aortica e mitrale sono ugualmente colpite. In questo caso, c'è una temperatura corporea elevata, grave intossicazione e brividi.
Ora riassumiamo tutti i sintomi elencati elencandoli:
- debolezza generale e malessere;
- perdita di appetito, perdita di peso;
- dispnea;
- aumento della temperatura fino a 40 gradi, accompagnato da forte sudorazione e forti brividi;
- pallore delle mucose e della pelle, la pelle acquisisce una tinta terrosa e giallastra;
- piccole emorragie sulle mucose della bocca, sulla pelle, sulle palpebre e sulla sclera;
- fragilità dei vasi sanguigni;
- modifica delle dita e delle unghie.
Se inizi a manifestare uno qualsiasi di questi sintomi, dovresti consultare immediatamente un medico. Se l'endocardite non viene rilevata in tempo, possono svilupparsi gravi complicazioni e la persona può persino morire. Naturalmente, il medico non farà subito una diagnosi. Innanzitutto, è necessario condurre una diagnosi approfondita delle condizioni corporee del paziente, che aiuterà a determinare la forma della malattia e a prescrivere un trattamento più efficace.
Diagnostica
La diagnostica include diversi metodi. Innanzitutto, è importante eseguire un esame del sangue dal paziente. L'endocardite infettiva viene rilevata dai seguenti indicatori:
- anemia moderata normocromica;
- leucocitosi e spostamento della formula dei leucociti a sinistra;
- un aumento della VES, che può persistere anche nonostante un trattamento efficace per sei mesi: allo stesso tempo, se la VES è normale, ciò non significa che si possa escludere un'endocardite infettiva;
- aumento della concentrazione di acidi sialici.

Per diagnosticare è necessario sottoporsi a una serie di esami
Il paziente viene sottoposto anche ad un esame delle urine. Nell'endocardite, questa analisi rivela proteinuria e microematuria, anche se non vi sono segni evidenti di danno renale. Se si sviluppa glomerulonefrite, l'ematuria e la proteinuria saranno più pronunciate.
Esiste una cosa chiamata coltura del sangue. Questa è una coltura di microbi isolata dal sangue. Questo test aiuta anche a identificare l'endocardite e la sua forma. Ad esempio, l'endocardite subacuta è definita da batteriemia persistente. In questo caso, il numero di batteri varia da uno a duecento ml. Per rilevare la batteriemia è necessario raccogliere il sangue venoso tre volte in un volume di circa venti millilitri. L'intervallo tra il primo e il terzo prelievo di sangue dovrebbe essere di un'ora. Se viene identificato un agente patogeno, è importante determinare quanto sia sensibile agli antibiotici.
Naturalmente, è importante determinare lo stato del cuore stesso. A questo scopo vengono utilizzati due metodi di ricerca.
- ECG. Possono essere rilevate anomalie della conduzione come blocco senoatriale o blocco AV. Se si verifica un danno embolico alle arterie coronarie, possono verificarsi alterazioni infartuali.
- Vegetazione EchoCG. La loro dimensione dovrebbe essere di circa cinque millimetri, quindi possono essere identificati. L'ecocardiografia transesofagea è considerata il metodo più sensibile per rilevare le vegetazioni. Questo metodo permette anche di identificare ascessi, perforazione delle valvole e rottura del seno di Valsalva. L'EchoCG è utile per monitorare l'efficacia del trattamento e la dinamica del processo.
Trattamento

Benzilpenicillina
Il trattamento dell'endocardite infettiva viene solitamente effettuato in un complesso, che si basa su un'adeguata terapia antimicrobica. Poiché la flora gram-positiva è spesso l'agente eziologico, il medico può iniziare il trattamento prescrivendo benzilpenicillina, la cui dose varia da 12 a 30 unità al giorno. Il corso dura solitamente circa quattro settimane. Se l'endocardite è causata dallo streptococco viridans, una combinazione di aminoglicosidi con penicillina può avere un buon effetto. Ad esempio, il medico può prescrivere la gentamicina. Possono essere utilizzate anche penicilline semisintetiche.
L'endocardite enterococcica si sviluppa solitamente a causa di interventi nel tratto gastrointestinale o genito-urinario. In questo caso la cefalosporina non è molto efficace, quindi si utilizza l'ampicillina o la vancomicina, combinandola con gli aminoglicosidi.
L'endocardite, causata dalla flora gram-negativa, Pseudomonas aeruginosa, Escherichia coli e così via, è difficile da trattare. In questo caso vengono utilizzate cefalosporine di terza e seconda generazione, ampicillina, carbenicillina, combinandole con aminoglicosidi. Grandi dosaggi vengono utilizzati per circa sei settimane.
I farmaci elencati, ovviamente, non sono gli unici utilizzati nel trattamento dell'endocardite. Ci sono altri farmaci che hanno proprietà antibatteriche. Potrebbe essere diossidina.
Se le manifestazioni immunologiche sono gravi e gli antibiotici non hanno un effetto sufficiente sui processi che si verificano, il medico può aggiungere ormoni al trattamento. In ogni caso, il medico ha raccomandazioni per il trattamento dell'endocardite. La nuova versione è stata rilasciata nel 2009, ci sono versioni pubblicate nel 2012 e in altri periodi. Solo il medico stesso può applicare efficacemente queste conoscenze a beneficio del paziente.
Inoltre, può essere presa la decisione di sottoporsi a un trattamento chirurgico. Comprende la rimozione delle vegetazioni e la sostituzione della valvola.
Le indicazioni per l'intervento chirurgico sono le seguenti:
- vegetazioni grandi e mobili sulle valvole, determinate durante l'ecografia del cuore;
- ascessi dell'anello valvolare e del miocardio;
- insufficienza cardiaca progressiva, osservata con gravi difetti valvolari e che non migliora con la terapia farmacologica;
- recidive precoci di endocardite;
- sindrome tromboembolica ricorrente.
Conseguenze
Per comprendere le conseguenze dell'endocardite infettiva, è necessario determinare di quali organi bersaglio stiamo parlando e come vengono colpiti esattamente.
- Cuore. Nel cuore possono verificarsi i seguenti cambiamenti negativi: aneurisma, ascesso, infarto, pericardite, miocardite, aritmia, insufficienza cardiaca.
- Vasi: aneurisma, vasculite, emorragia, trombosi, tromboembolia.
- Reni. Possibile sviluppo di insufficienza renale. attacco cardiaco, glomerulonefrite diffusa, nefrite focale e sindrome nefrosica.
- I danni al sistema nervoso comprendono ascessi, meningoencefalite, cisti e disturbi circolatori cerebrali transitori.
- I polmoni possono andare incontro ad ascesso, infarto, polmonite e ipertensione polmonare.
- Milza: infarto, rottura, ascesso, splenomegalia.
- Fegato: epatite.

La malattia può colpire sia tutti che i singoli organi
La lesione può colpire tutti gli organi bersaglio o alcuni di essi. In generale, la prognosi dipende da fattori come le lesioni valvolari esistenti, l'adeguatezza e la tempestività della terapia, e così via. Se la forma acuta non viene trattata la morte avviene dopo circa un mese e mezzo, mentre nella forma subacuta dopo sei mesi. Se la terapia antibatterica è adeguata, la mortalità si osserva nel 30% dei casi e se si verifica un'infezione delle valvole protesiche, nel 50% dei casi.
Nei pazienti anziani, la malattia progredisce in modo indolente. Spesso viene rilevato tardi, quindi la prognosi è peggiore. L’endocardite infettiva è una delle gravi cause di mortalità tra i bambini. L'endocardite infettiva nei bambini si sviluppa spesso a causa di un comportamento genitoriale improprio, sia prima che durante la gravidanza. Per preservare la vita sia degli adulti che dei bambini, è molto importante seguire misure preventive.
Prevenzione
Le misure preventive sono importanti sia per chi vuole prevenire completamente l’insorgenza della malattia, sia per chi ne è già stata diagnosticata. Per i soggetti appartenenti a quest'ultimo gruppo, la prevenzione è importante per garantire che l'endocardite non progredisca e si sviluppi in altre forme più gravi. È importante che le persone a rischio elevato siano regolarmente osservate dai medici e monitorino la loro salute.

È importante evitare infezioni batteriche e virali: mal di gola, influenza, ecc.
Naturalmente, uno stile di vita sano non ha mai danneggiato nessuno, quindi è necessario monitorare quale cibo entra nel nostro corpo, se è sufficientemente attivo e se il regime di riposo e di lavoro è corretto. Tutti questi fattori aiuteranno a mantenere le condizioni del tuo cuore al livello adeguato, il che prolungherà la vita e salverà te e i tuoi cari da problemi inutili.
L'endocardite infettiva è caratterizzata da danni al rivestimento interno e alle valvole del cuore, il meccanismo della valvola aortica. Sullo sfondo della malattia si sviluppano rapidamente insufficienza cardiaca, embolia del sistema circolatorio e malattie di altri sistemi e organi interni. La patologia si riferisce a una forma grave in cui la morte è possibile.
Caratteristiche generali, tipologie e forme
Di natura infettiva: si tratta di un'infiammazione dell'endocardio (rivestimento interno). Si verifica sullo sfondo dell'infezione da parte di agenti patogeni di vari agenti. Molto spesso, la patologia si verifica negli uomini; l'età non è tipica dell'infezione. Il periodo di incubazione dipende direttamente dal tipo di agente patogeno, quindi può variare da diversi giorni a mesi. Questo processo è influenzato anche dallo stato del sistema immunitario della persona infetta: più forte è l'immunità, più a lungo i batteri non si manifestano.
I microrganismi patogeni penetrano nell'endocardio attraverso il fluido sanguigno. Inizialmente localizzato nella camera e nella cavità cardiaca, attaccandosi ai lembi della valvola. Poi crescono, formando intere colonie. Questo processo di vegetazione porta alla deformazione delle valvole, alla formazione di superfici tuberose e di ulcere che contengono depositi trombotici. Con danni significativi, il sistema valvolare smette di chiudersi, motivo per cui si sviluppano disturbi emodinamici che portano allo scompenso cardiaco.
Il pericolo principale risiede nella rottura dei lembi valvolari, i cui pezzi possono diffondersi nei piccoli e grandi circoli della circolazione sanguigna. E questo provoca danni ischemici non solo al cuore, ma anche al cervello e ad altri organi interni. L'ischemia, a sua volta, porta a disturbi neurologici, paralisi, paresi, ecc.
Classificazione in base al tipo di gravità dell'endocardite infettiva:
- La setticemia acuta si sviluppa molto rapidamente. A volte bastano poche ore. Anche le complicazioni si sviluppano rapidamente, il che è pericoloso per la vita umana. Se l'agente patogeno ha un alto livello di virulenza, penetra anche nei tessuti degli organi vicini. I principali batteri sono gli stafilococchi.
- Il decorso subacuto è caratterizzato da uno sviluppo lento. Dal giorno dell'infezione alla comparsa dei primi sintomi possono trascorrere diverse settimane e talvolta mesi. I tessuti circostanti non vengono colpiti, il batterio non mostra aggressività. Gli agenti patogeni più comuni sono lo streptococco e lo Staphylococcus aureus.
- Flusso prolungato.
Forme della malattia:
- forma primaria: danno all'endocardite per la prima volta;
- forma secondaria: lo sviluppo della malattia avviene a causa della presenza di malattie del sistema cardiovascolare;
- forma protesica – l’impianto (valvola artificiale) si infetta.
Altre classificazioni dell'endocardite infettiva:
- la malattia può essere attiva, guarita o recidivante;
- la diagnosi può essere probabile o certa;
- tipo di patogeno – determinato o non determinato.
L’endocardite infettiva, che si verifica nella parte destra del cuore, si sviluppa molto spesso nei tossicodipendenti perché i batteri della pelle entrano nel flusso sanguigno.
Cause
Oggi l’incidenza dell’endocardite virale e batterica è aumentata in modo significativo. Ciò è dovuto a due ragioni principali: in primo luogo, il numero di tossicodipendenti è aumentato e, in secondo luogo, virus e batteri mutano nel tempo, adattandosi a qualsiasi condizione. Gli agenti patogeni diventano più resistenti agli agenti antibatterici e antivirali.
Principali agenti patogeni Gram-positivi:
- Staphylococcus aureus;
- enterococco;
- streptococco;
- candida;
- Coxiella.
Non solo i microrganismi patogeni di cui sopra possono diventare agenti causali dell'endocardite infettiva. Si scopre che assolutamente qualsiasi batterio può essere la causa. Questi possono essere agenti patogeni gram-negativi, funghi, batteri atipici.
I batteri iniziano a moltiplicarsi attivamente solo in condizioni di un ambiente favorevole, che si verifica in questi casi:
- danno alle gengive e alla mucosa orale (a casa o in odontoiatria);
- broncoscopia: gli strumenti duri danneggiano le superfici;
- intervento chirurgico o misure diagnostiche effettuate sugli organi urinari;
- danno al sistema genito-urinario di donne e uomini durante interventi chirurgici e ricerche:
- tonsillectomia o adenoidectomia;
- manipolazioni con le vie biliari;
- litotrissia;
- chirurgia ginecologica.
Gruppi a rischio:
- persone che hanno già sofferto una volta di endocardite di tipo batterico;
- pazienti sottoposti a impianto di sistemi valvolari: molto spesso l'infezione si verifica quando si utilizzano materiali meccanici e biologici;
- persone con difetti cardiaci congeniti e acquisiti, spesso in presenza di disturbi nei ventricoli cardiaci e nell'aorta;
- la presenza di prolasso della valvola mitrale;
- Cardiomiopatia ipertrofica;
- ischemia dei vasi sanguigni e del cuore;
- presenza di pacemaker e defibrillatori;
- attacchi reumatici;
- difetti interatriali e interventricolari nei setti.

Sintomi di endocardite infettiva
Il sintomo principale della malattia è la febbre. L'aumento della temperatura avviene gradualmente.
Si osservano inoltre i seguenti segnali:
- debolezza generale;
- fatica;
- sensazione di brividi;
- sudorazioni notturne;
- perdita di peso;
- dolori articolari e alla schiena.
Forme croniche endocardite virale presentano i seguenti sintomi:
- cambiamento nella carnagione (pallore);
- temperatura elevata (fino a 38 gradi);
- respirazione rapida e frequenza cardiaca;
- macchie di sangue negli occhi;
- sviluppo di congiuntivite;
- formazioni dermatologiche in tutto il corpo;
- oscuramento delle unghie;
- Se la malattia non viene curata per un lungo periodo, le falangi delle dita cambiano: diventano spesse.
Un lungo decorso della malattia può portare ai seguenti sintomi:
- ingrossamento degli organi interni (principalmente la milza);
- gonfiore degli arti.
Endocardite batterica del lato destro caratterizzato da:
- processo infiammatorio delle pareti dei vasi sanguigni;
- febbre;
- dolore al petto;
- espettorazione di sangue;
- edema polmonare.
Diagnostica
Le misure diagnostiche per l'endocardite infettiva mirano a identificare la causa principale della patologia e l'agente patogeno stesso. È anche importante effettuare una terapia sintomatica. Pertanto, vengono utilizzati i seguenti metodi di esame:
- La diagnostica di laboratorio prevede la raccolta di esami del sangue e talvolta di esami delle urine. I batteri vengono identificati e il loro tipo viene determinato.
- La diagnostica strumentale esamina il cuore, il sistema circolatorio e, se necessario, altri organi interni. È possibile determinare la causa dello sviluppo della patologia e il grado di danno da parte degli agenti patogeni, sulla base del quale viene prescritta una terapia adeguata.
Trattamento dell'endocardite infettiva
Trattamento farmacologico
Prima di tutto è necessario eliminare l'agente patogeno. A questo scopo vengono utilizzati agenti antivirali, antibiotici o farmaci antifungini. La terapia farmacologica viene effettuata immediatamente dopo l'identificazione dell'agente patogeno.
Vengono utilizzati i seguenti gruppi di farmaci:
- per qualsiasi tipo di stafilococco vengono utilizzati i seguenti farmaci antibatterici: Ceftriaxone, Benzilpenicillina, Gentamicina, Vancomicina, Amoxicillina, Ampicillina, Cefazolina, Linezolid, Imipenem, Oxacillina;
- per gli enterococchi: Ampicillina, Benzilpenicillina, Gentamicina;
- per pneumococchi: Levofloxacina, Cefotaxime, Linezolid;
- per i batteri NASEK: Ampicillina, Gentamicina, Ceftriaxone;
- per Pseudomonas aeruginosa - solo Ceftazidima;
- per le infezioni fungine: Flucitosina, Meropenem, Amikacina, Amfotericina B.

La durata della terapia farmacologica varia da 2 settimane a 2 mesi, a seconda dell'entità della lesione. Il dosaggio è prescritto esclusivamente dal medico curante, tenendo conto delle caratteristiche individuali del decorso della malattia e dell'organismo.
È inoltre necessario eliminare la temperatura corporea elevata, ridurre il livello di VES e altre sostanze nel sangue, neutralizzare i sintomi e anche prevenire l'ulteriore crescita e diffusione dell'agente patogeno. Pertanto, viene utilizzata la seguente terapia complessa:
- per eliminare i processi infiammatori vengono utilizzati farmaci glucocorticosteroidi, principalmente Prednisolone;
- inibitori dell'enzima di conversione dell'angiotensina;
- diuretici;
- gruppo di glicosidi;
- beta e bloccanti adrenergici;
- agenti antipiastrinici;
- antagonisti dell'aldosterone.
Questi farmaci hanno un effetto benefico sul sistema cardiovascolare, migliorandone la funzionalità, riducendo lo stress e prevenendo la formazione di coaguli di sangue.
Metodi chirurgici di trattamento
La chirurgia viene utilizzata solo in casi estremi, quando il trattamento farmacologico non ha senso, nonché in presenza di complicanze. Le principali indicazioni per l'intervento chirurgico per l'endocardite infettiva:
- sviluppo di insufficienza cardiaca non trattata con farmaci;
- accumuli purulenti nell'endocardio;
- presenza di una valvola meccanica;
- un numero eccessivamente elevato di colonie patogene.
Oggi vengono spesso utilizzate tecniche chirurgiche sanative. Ad esempio, una toracotomia, in cui il torace viene aperto e il cuore è collegato ad apparecchiature di pompaggio che svolgono la funzione di circolazione artificiale. La sanificazione viene effettuata con le seguenti modalità:
- rimozione meccanica delle colonie di agenti patogeni e delle aree colpite del cuore;
- trattamento antisettico di parti del cuore utilizzando un metodo chimico;
- sanificazione ad ultrasuoni di tessuti e organi inaccessibili per la rimozione.
Se le valvole interessate sono state rimosse, il medico deve sostituirle con organi artificiali. Ma questa procedura viene eseguita separatamente dalla toracotomia.
L'intervento chirurgico non garantisce la completa eliminazione dell'agente patogeno, quindi viene comunque utilizzata la terapia farmacologica.
Prognosi, possibili complicanze
Anche con un trattamento adeguato e un recupero completo, il paziente può manifestare complicazioni dopo un po’ di tempo. Gli esperti mettono sempre in guardia sui possibili cambiamenti dello stato di salute. Le principali complicanze dopo l'endocardite infettiva sono le seguenti:
Insufficienza cardiaca cronica
È considerata una patologia grave in cui il cuore non è in grado di pompare la quantità di sangue necessaria. Ciò è dovuto al danno al tessuto muscolare del cuore e alle sue valvole. Nell’insufficienza cardiaca, la circolazione sanguigna è compromessa, il che porta a una diminuzione dei livelli di ossigeno nel sangue. Questa complicazione può essere curata con un intervento chirurgico. I medici sostituiscono la valvola cardiaca danneggiata con un impianto artificiale. Se riesci a sbarazzarti dell'endocardite batterica in modo tempestivo, il grado di complicanze diminuirà.

Blocco delle arterie dovuto a coaguli di sangue (tromboembolia)
Questa complicazione può causare la morte del paziente. Si formano coaguli di sangue sulle pareti delle valvole. Possono essere mobili o in via di sviluppo. Il rischio di entrare nel flusso sanguigno è molto alto. Se il tromboembolismo si sviluppa nel ventricolo destro, quando si sposta il trombo entra nella circolazione polmonare. Il blocco si verifica nel sistema vascolare dei polmoni, che interrompe lo scambio di ossigeno. Se si forma un coagulo di sangue nella parte sinistra del ventricolo cardiaco, il blocco può verificarsi in diverse parti del corpo. Tali movimenti di un coagulo di sangue attraverso il sistema circolatorio sono pericolosi per la vita; senza cure mediche urgenti, una persona muore.
I vasi più suscettibili al blocco da parte di coaguli di sangue dal ventricolo sinistro sono:
- valvola arteriosa della milza;
- arterie del cervello;
- vasi delle estremità;
- arterie intestinali;
- vasi oculari.
Per rilevare il tromboembolismo, gli specialisti prescrivono l'ecocardiografia. I coaguli di sangue vengono rimossi o prevenuti.
Lungo processo di infezione
Dopo l’endocardite infettiva, i batteri continuano a svilupparsi nel cuore. I microrganismi diventano la causa delle complicanze. Una circolazione sanguigna prolungata con virus può colpire organi e tessuti interni. Il paziente si sente male, debole, avverte febbre, dolore alla testa e ai muscoli. Il trattamento è costoso e lungo.
In questo caso si verificano le seguenti violazioni:
- infarto della milza e del cuore;
- ascessi polmonari, ipertensione, edema e polmonite;
- epatite;
- pericardite e persino ascessi cardiaci;
- meningite e cisti;
- tromboflebiti, aneurismi, vasculiti e trombosi nel sistema circolatorio;
- insufficienza cardiaca.
Prevenzione
L'endocardite infettiva non si trasmette in alcun modo, quindi il rischio di infezione è pari a zero. Per evitare il verificarsi di questa malattia, dovresti seguire questi suggerimenti:
- cerca di non prendere troppo freddo;
- non portare malattie infettive ai piedi;
- condurre uno stile di vita attivo;
- fare sport;
- eliminare l'alcol e il fumo;
- seguire una dieta corretta;
- escludere contatti con pazienti ARVI;
- se hai patologie infettive di qualche organo, chiedi aiuto a uno specialista;
- eseguire procedure diagnostiche e operazioni in cliniche con una buona reputazione, ciò ridurrà il rischio di infezione durante la procedura;
- sbarazzarsi delle malattie del sistema cardiovascolare;
- visitare i medici più spesso.
Opinione dei medici sull'endocardite - video
Come si sviluppa l'endocardite infettiva, quali sono i sintomi e le cause, quali metodi di trattamento vengono utilizzati? Guarda questo e molto altro nel nostro video:
Un sistema immunitario indebolito contribuisce anche allo sviluppo dell'endocardite infettiva. Pertanto, è necessario monitorare lo stato del sistema immunitario: consumare più vitamine naturali, arricchire il corpo con minerali e oligoelementi. Ai primi segni della malattia, dovresti contattare la clinica.
L'endocardite infettiva (IE) - un'infezione microbica intravascolare sull'endocardio delle strutture cardiovascolari e sui materiali estranei intracardiaci lungo il percorso del flusso sanguigno, rimane una malattia grave e scarsamente prevedibile. Il numero delle endocarditi nosocomiali e delle endocarditi del cuore operato è in aumento; l’EI nei tossicodipendenti e l’EI primaria negli anziani sono diventate più comuni.
I principali agenti causali dell'EI sono lo streptococco viridans, gli stafilococchi aureus e coagulasi negativi, gli enterococchi.
La diagnosi di EI si basa sulle manifestazioni cliniche della malattia (febbre, soffio cardiaco, splenomegalia, vasculite periferica), confermate da un'emocoltura positiva con identificazione dell'agente patogeno e dai dati ecocardiografici (segni di distruzione valvolare, vegetazione sulle valvole e strutture sottovalvolari). Il risultato dell'infezione valvolare è la formazione di un difetto cardiaco nell'EI primaria (endocardite su cuore intatto) e un cambiamento nella forma del difetto nei pazienti con malattie cardiache sottostanti (IE secondaria). Secondo il decorso clinico, tradizionalmente si distingue l'endocardite acuta e subacuta. Le principali complicanze dell’EI sono l’insufficienza cardiaca progressiva e il tromboembolismo. Alcuni pazienti sviluppano sindromi sistemiche da complessi immunitari (glomerulonefrite, vasculite, miocardite, sierosite). Nel trattamento dell'EI, il ruolo principale è svolto dall'uso di antibiotici battericidi per cicli lunghi (4-6 settimane), solitamente in una combinazione di 2 o 3 farmaci, e dal trattamento chirurgico (sostituzione della valvola).
Parole chiave: endocardite infettiva, agenti patogeni, diagnostica ecografica, terapia antibatterica, trattamento chirurgico.
INTRODUZIONE
Nella letteratura nazionale, le prime descrizioni e studi di IE appartengono a V.I. Ilyinsky e M. Shah-Paronian (1864), A.P. Langovoy (1884), all'estero - a V. Osler (1885), E. Liebman e G. Schotmuller (1910). Nel 1941 B.A. Chernogubov ha avanzato il concetto di indipendenza della cosiddetta endocardite settica “prolungata” rispetto ai difetti cardiaci reumatici, come i suoi predecessori.
L'EI è una malattia relativamente rara, l'incidenza varia da 16 a 116 casi per 1 milione di abitanti all'anno in diverse regioni. La malattia può manifestarsi a qualsiasi età; attualmente la percentuale di pazienti anziani e senili è aumentata in modo significativo (circa il 50%), gli uomini sono più spesso colpiti.
La diagnosi e il trattamento dell'EI rappresentano uno dei problemi più difficili della cardiologia moderna. La crescente refrattarietà della microflora, il processo distruttivo nell'apparato valvolare, l'insufficienza cardiaca progressiva sullo sfondo della distruzione delle valvole cardiache, il tromboembolia da vegetazioni valvolari determinano una prognosi grave della malattia (la mortalità ospedaliera è del 16-27%) .
Particolarmente difficili nella gestione dei pazienti con EI sono gruppi di pazienti con sindromi da immunodeficienza: persone infette da HIV, pazienti con AIDS. Sono importanti anche altre cause di compromissione del sistema immunitario, disadattamento sociale, tossicodipendenza, alcolismo e uso di immunosoppressori.
DEFINIZIONE E CLASSIFICAZIONE DI IE
L'EI è un'infezione microbica intravascolare localizzata sull'endocardio delle strutture cardiovascolari e sui materiali estranei intracardiaci situati nel percorso del flusso sanguigno.
La malattia è solitamente caratterizzata dalla localizzazione dell'infezione sulla valvola, meno comunemente sull'endocardio parietale o sull'endotelio dei grandi vasi; accompagnato dalla formazione di difetti cardiaci (rigurgito valvolare) e insufficienza cardiaca progressiva. Una percentuale significativa di pazienti presenta tromboembolia e lesioni del complesso immunitario: vasculite, glomerulonefrite, sierosite.
L'IE porta alla distruzione della valvola e alla formazione di malattie cardiache.
La classificazione operativa dell’IE identifica:
Secondo il corso: IE acuta e IE subacuta.
Decorso subacuto L'EI è il più comune (circa il 90% di tutti i casi di IE). Le malattie cardiache di solito si sviluppano entro 1 mese, la durata della malattia va da 1,5 a 3-4 mesi. Nella pratica clinica, il cardiologo incontra molto spesso un decorso subacuto, quindi questa opzione sarà descritta in dettaglio nella sezione "quadro clinico della malattia". Nella letteratura nazionale ed europea si distingue anche un decorso prolungato di EI (una forma lieve di EI subacuta). Questa forma della malattia può essere causata da microrganismi a bassa virulenza (streptococco, pneumococco), ha un decorso relativamente benigno e spesso presenta notevoli difficoltà nella diagnosi differenziale con altre malattie cardiache infiammatorie. EI prolungata senza chiari segni di malattia, con subfebbre
la temperatura del fluido può essere osservata in pazienti indeboliti con grave insufficienza cardiaca, epatite grave o nefrite con insufficienza renale e in pazienti anziani.
IE acuta ha una durata del corso fino a 1,5 mesi. Questa è sepsi con localizzazione valvolare dell'infezione. La distruzione della valvola può svilupparsi molto rapidamente - entro 7-10 giorni dalla comparsa dei primi segni della malattia, che richiede un trattamento chirurgico immediato - protesica della valvola interessata. La malattia è solitamente causata da una flora altamente virulenta (Staphylococcus aureus, microrganismi NASEK, Pseudomonas aeruginosa, funghi patogeni, ecc.), Ha un decorso grave e si sviluppa rapidamente insufficienza cardiaca. La prognosi è molto grave; le dosi massime di moderni antibiotici battericidi, così come il trattamento chirurgico, non sempre aiutano; spesso si osservano ascessi miocardici, generalizzazione del processo e sviluppo di sepsi. Questa forma di EI è rara (meno del 10%).
Quando la terapia antibatterica viene prescritta precocemente, si notano differenze nel corso acuto E subacuto L'EI è spesso vaga, quindi gli esperti della Società Europea di Cardiologia (2004) non raccomandano di differenziare le forme acute e subacute nella diagnosi di EI.
L'IE subacuta è la più comune.
In base allo stato precedente delle strutture cardiache interessate, si distingue l'IE sulle valvole naturali, comprese le primarie (sulle valvole intatte) e le secondarie (sulle valvole cardiache precedentemente danneggiate), e l'IE delle valvole protesiche, che è divisa in precoce (fino a 1 anno dopo l’intervento al cuore) e tardi. Attualmente predomina l’EI primaria (circa il 60-80% di tutti i casi della malattia). L'EI primaria è solitamente causata da microrganismi più virulenti (Staphylococcus aureus, microrganismi NASEK, Enterococcus, ecc.) ed è più grave dell'EI secondaria. L'EI secondaria si sviluppa sullo sfondo di una malattia cardiaca esistente: difetti cardiaci (reumatici, calcifici degenerativi negli anziani, traumatici, congeniti), cardiomiopatia. Le EI secondarie sono spesso causate da infezioni streptococciche e sono più lievi di quelle primarie.
La forma predominante di IE è il processo su una valvola precedentemente invariata (IE primaria).
Ci sono opzioni speciali per IE:
IE dei tossicodipendenti;
EI parietale;
IE nell'emodialisi cronica;
EI nelle cardiomiopatie (ipertrofiche, congestizie, restrittive);
EI nosocomiale (avvenuta dopo più di 72 ore dal ricovero o direttamente associata a procedure invasive in un ospedale nei 6 mesi precedenti);
Presenza o assenza di IE nel passato
IE è apparso per la prima volta
EI ripetuta o recidiva di EI (un nuovo episodio di EI dopo che l'infezione di un precedente episodio di EI si è risolta);
Attività di processo
L'IE attiva è caratterizzata da febbre in combinazione con la rilevazione di microrganismi nel sangue o nel materiale ottenuto durante l'intervento chirurgico,
IE precedente (guarito);
Stato diagnostico
EI affidabile (secondo i criteri diagnostici Duke IE modificati, 2000),
Possibile EI (vi sono seri motivi clinici per sospettare EI, ma il danno endocardico non è stato ancora dimostrato, oppure una potenziale diagnosi di EI è considerata nella diagnosi differenziale di un paziente febbrile, EI non è stata esclusa);
Localizzazione di IE
IE con malattia della valvola mitrale,
IE con danno alla valvola aortica,
IE con danno alla valvola tricuspide,
IE con malattia della valvola polmonare,
IE parietale,
Caratteristiche microbiologiche dell'EI
Tipo di agente patogeno (EI streptococcica, EI stafilococcica, ecc.).
IE con emocoltura negativa.
EI sierologicamente negativa.
IE PCR-negativo.
Gruppo dello streptococco viridans (S.sanguis, S.oralis, S.salivaris, S.mutans, S.milleri, Gemella morbillorum)è stato identificato da G. Schotmuller come il principale agente eziologico dell'EI all'inizio del XX secolo. L'agente patogeno rimane importante anche oggi e spesso provoca EI dopo varie manipolazioni nella cavità orale - per malattia parodontale, estrazione di denti, tonsillectomia, ecc. Questa IE di solito risponde bene al trattamento con penicilline e cefalosporine, tuttavia, negli ultimi anni, sono apparse anche forme resistenti stato scoperto.
Staphylococcus aureus e coagulasi negativo (S. epidermidis e altri), attualmente predominano tra gli agenti causali dell'EI. Di norma si tratta di forme gravi della malattia; la scelta degli antibiotici necessari è difficile, poiché aumenta l'incidenza di stafilococchi resistenti a oxacillina/meticillina; spesso è necessario un trattamento chirurgico: sostituzione della valvola. Gli stafilococchi sono patogeni comuni dell'EI nei tossicodipendenti.
L'importanza dei microrganismi gram-negativi nell'eziologia della malattia è aumentata: Escherichia coli, Pseudomonas aeruginosa, Enterobacteriaceae, Salmonella, ecc. Microrganismi NASEK (Haemophilus aprophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae), abitanti comuni delle vie respiratorie superiori dell'uomo, oggi sono spesso anche agenti causali dell'EI. Occasionalmente, di regola, con l'EI nei tossicodipendenti si osserva un'associazione polimicrobica.
Gli agenti causali più comuni dell'EI sono gli stafilococchi (aurus e coagulasi-negativi) e gli streptococchi.
Studi microbiologici per l'EI
La varietà di agenti patogeni dell'IE moderna rende piuttosto difficile il compito di isolarli dal sangue; l'identificazione qualitativa dell'agente patogeno richiede competenze speciali da parte del personale medico, un laboratorio microbiologico attrezzato con terreni nutritivi cumulativi e una serie di terreni per diversi microrganismi. Se si sospetta un'endocardite infettiva, è ovvio che le emocolture debbano essere eseguite il più rapidamente possibile prima della prescrizione degli antibiotici - entro le prime 24-48 ore secondo le attuali raccomandazioni (American
Tabella 5.2
Gli agenti patogeni più probabili in gruppi di pazienti con EI a seconda delle situazioni epidemiologiche
(Associazione americana del cuore, 2005)
Segno epidemiologico | Agenti patogeni tipici dell'EI |
Pazienti sottoposti a sostituzione della valvola cardiaca meno di un anno fa (endocardite protesica valvolare precoce) | Stafilococchi coagulasi negativi, S. aureus, bastoncini gram-negativi aerobici, funghi, Corinebatterio |
Pazienti sottoposti a intervento chirurgico di sostituzione della valvola cardiaca più di un anno fa (protesi valvolare tardiva IE) | S. aureus, Streptococchi del gruppo viridans, enterococchi, funghi, gruppo NASEK |
Abusatori di droghe (uso di droghe per via endovenosa), pazienti ospedalizzati con cateteri endovenosi e altri dispositivi intravascolari | S. aureus, compresi i ceppi resistenti all'oxacillina; stafilococchi coagulasi negativi, streptococchi β-emolitici, funghi, batteri aerobi gram-negativi, compresi Pseudomonas aeruginosa, associazione polimicrobica |
Pazienti con dispositivi intracardiaci permanenti | S.aureus, stafilococchi coagulasi-negativi, funghi, batteri aerobi gram-negativi, Corinebatterio |
Pazienti con malattie e infezioni del sistema genito-urinario, dopo interventi sul tratto genito-urinario, parto, aborto | Enterococco, streptococchi di gruppo B (S.agalactiae), Listeria monocytogenes, batteri aerobi gram-negativi, Neisseria gonorrhoeae |
Pazienti con malattie croniche della pelle, comprese le infezioni | S. aureus, Streptococchi I-emolitici |
Pazienti con cattive condizioni dentali dopo procedure di trattamento dentale | Gruppo Streptococcus viridans, Abiotrofia difettosa, Granulicatella, Gemella, Gruppo NASEK |
Fine del tavolo. 5.2
Pazienti con malattie intestinali | S.bovis, Enterococcus, Closnridium septicum |
Pazienti con alcolismo e cirrosi epatica | Bartonella, Aeromonas, Listeria, S.polmonite, I - streptococchi emolitici |
Pazienti con ustioni | S. aureus, funghi, batteri aerobi gram-negativi, inclusi P. aeruginosa |
Pazienti con diabete | S. aureus, Sono streptococco emolitico, S.polmonite |
Dopo i morsi di cane e gatto | Bartonella, Pasteurella, Capnocytophaga |
Contatto con latte contaminato e animali da allevamento contaminati | Brucella, Coxiella burnetii, Erysipelothrix |
Pazienti con condizioni immunosoppressive (infezione da HIV, tumori solidi, trapianto di organi, uso a lungo termine di glucocorticoidi, citostatici) | S.aureus, Salmonella, S.polmonite, Aspergillus, Candida, Enterococcus |
Pazienti con polmonite, meningite | S.polmonite |
Associazione del cuore, 2006). La mancanza di crescita è spesso associata alle emocolture di un paziente che riceve antibiotici. Se il paziente ha già ricevuto antibiotici, le colture devono essere effettuate tre giorni dopo l'interruzione del trattamento antibiotico a breve termine o 6-7 giorni dopo l'interruzione del trattamento antibiotico a lungo termine, se le condizioni del paziente lo consentono.
Coltura del sangue. Per rilevare la batteriemia, si consiglia di prelevare campioni separati di sangue venoso in una quantità di 5-10 ml almeno tre volte con un intervallo di 1 ora, indipendentemente dalla temperatura corporea. Quando si identifica un agente patogeno, è necessario determinarne la sensibilità agli antibiotici. Poiché non tutti i microrganismi in coltura possono essere riconosciuti come l'agente eziologico dell'EI, si ritiene che entro 3 giorni il paziente debba sottoporsi a 10-12 colture e se lo stesso microbo viene isolato in 2-3 di esse, allora può essere riconosciuto come il vero agente patogeno. Le singole semine possono essere associate a contaminazione dell’ambiente, delle mani del personale, errori nelle apparecchiature batteriologiche, ecc.
Metodi sierologici e studi PCR efficace nella diagnosi di EI causata da colture difficili Bartonella, Legionella, Clamidia, Coxiella burnetti E Troferima.
Il rispetto delle regole raccomandate per l'emocoltura e l'uso di moderni metodi sierologici o molecolari per l'identificazione dei microrganismi in caso di risultati negativi della coltura ci consente di determinare l'eziologia dell'endocardite infettiva nell'80-90% dei pazienti.
Tuttavia, nel 5-20% dei pazienti l'emocoltura non è isolata. I patogeni rari dell'EI che non crescono sui terreni convenzionali o che non richiedono la diagnosi sierologica includono: Bartonella, Chlamydia, Coxiella burnetii, Brucella, Legionella, Tropheryma whippleii, Nocardia, Non- Candida funghi (Aspergillo). Con un'emocoltura negativa, la malattia può essere più grave e la sua prognosi è molto peggiore rispetto ai pazienti con un'emocoltura nota.
PATOGENESI
L'EI dovrebbe essere considerata una malattia indipendente e non una manifestazione privata della sepsi. Alla luce della teoria della “cascata settica” (H.S. Warren, 1999), la malattia esordisce come un problema valvolare
infezione con successiva inclusione di infiammazione sistemica e generalizzazione a sepsi nelle forme acute. La causa principale dell’EI acuta è l’elevato numero e la virulenza dei batteri. Allo stesso tempo, nell'EI acuta e subacuta, l'immunocompromissione può fungere da sfondo sul quale si sviluppa più facilmente una malattia infettiva (pazienti con alcolismo cronico, tossicodipendenti, persone con infezione da HIV, pazienti con cirrosi epatica e altri).
Infezione iniziale dell'endocardio proviene dal flusso sanguigno durante la batteriemia. L'ingresso di microrganismi nel flusso sanguigno è facilitato da: cattive condizioni dentali, lesioni e infezioni della pelle, processi suppurativi, ustioni, infezioni focali, malattie infiammatorie croniche o tumori dell'intestino, organi genitourinari, tossicodipendenza (uso di droghe per via endovenosa). La batteriemia iatrogena si verifica durante procedure dentistiche e altre procedure mediche invasive, in particolare come chirurgia cardiaca aperta, cateteri endovenosi e dispositivi intracardiaci ed emodialisi. Spesso l'EI, soprattutto subacuta, causata dalla flora gram-positiva, si sviluppa a causa di una batteriemia transitoria senza “porte” visibili dell'infezione.
La colonizzazione iniziale dell'endocardio durante la batteriemia è presumibilmente facilitata da due condizioni: 1) microdanno meccanico dell'endotelio, che porta al contatto diretto del sangue con le strutture subendoteliali e provoca la deposizione nei siti di danno di minuscoli coaguli di sangue a cui si attaccano batteri, in particolare streptococchi, sono attaccati; i batteri fissati alla fibrina attraggono i monociti e inducono la loro produzione di fattore tissutale e citochine; questi mediatori attivano le piastrine, la cascata della coagulazione e la produzione di citochine, integrine e fattore tissutale da parte delle cellule endoteliali adiacenti, provocando la crescita di vegetazioni trombotiche infette. 2) infiammazione locale, che promuove l'espressione di N-integrine da parte delle cellule endoteliali, che legano la fibronectina plasmatica e facilitano la fissazione sull'endotelio di agenti patogeni che presentano proteine leganti la fibronectina sulla superficie, come lo Staphylococcus aureus. In risposta all'invasione batterica, le cellule endoteliali producono fattori tissutali e citochine, tra cui la coagulazione del sangue, la propagazione dell'infiammazione e la formazione di vegetazioni infette; batteri, che secernono proteine attive di membrana, lisi
le cellule endoteliali vengono distrutte. La tromboendocardite non infettiva - microtrombi sull'endocardio - si forma più spesso in luoghi di microtraumi emodinamici associati ad alcuni disturbi emodinamici dovuti a difetti cardiaci. L'EI può verificarsi in assenza di qualsiasi patologia cardiaca precedente, ma il rischio di EI è significativamente più elevato tra i pazienti con difetti cardiaci, precedente EI, protesi valvolari e chirurgia cardiaca ricostruttiva, prolasso della valvola mitrale e cardiomiopatia ipertrofica.
Nei casi di EI primaria, vengono prese in considerazione le seguenti possibilità per lo sviluppo di tromboendocardite non infettiva. Nei pazienti anziani e senili, i cambiamenti calcifici degenerativi nelle valvole mitrale e aortica e i disturbi dell'omeostasi reologica legati all'età svolgono un ruolo importante. Per i pazienti giovani vengono considerate condizioni riprodotte sperimentalmente in cui, a causa dell'ipercoagulazione, è possibile la formazione di trombi in vari distretti del sistema cardiovascolare e, in particolare, sull'endocardio valvolare; tali condizioni sono stress (sforzo fisico, freddo, psico-emotivo), disadattamento sociale, comprese, insieme alle violazioni delle norme nutrizionali, igieniche e le condizioni di stress sopra menzionate).
Le proprietà dei microrganismi che determinano la loro capacità di aderire ai microtrombi, così come la loro resistenza all'attività battericida del siero, sono uno dei motivi della predominanza dei singoli microrganismi nella struttura eziologica dell'EI.
Danni cardiaci in IE caratterizzato da:
Formazione sulla superficie dell'endocardio "vegetazione" contenenti piastrine, fibrina, globuli rossi, cellule infiammatorie e colonie di microrganismi. La proliferazione di microrganismi nella vegetazione, provocando un'ulteriore crescita della vegetazione, per ragioni non specificate va oltre il controllo dei meccanismi di difesa antinfettivi dell'organismo e, senza trattamento antibiotico o trattamento chirurgico, l'endocardite progredisce portando alla morte del paziente.
Man mano che IE progredisce, ulcerazioni, rotture, distruzione di valvole, nonché diffusione dell'infezione ad altre strutture del cuore: ascessi delle aree adiacenti del miocardio e anello fibroso della valvola, aneurisma del seno di Valsalva, formazione di fistole intracardiache.
Questi cambiamenti patologici portano a rigurgito valvolare(acuta o subacuta), lo sviluppo di insufficienza cardiaca nella maggior parte dei pazienti durante i diversi periodi della malattia e la comparsa di nuovi disturbi della conduzione quando sono coinvolte le vie.
La velocità di sviluppo e il grado dei processi distruttivi in IE non hanno analoghi. Nell'EI acuta le strutture valvolari vengono distrutte nel giro di pochi giorni, tanto da rendere necessario un trattamento chirurgico immediato, pena la morte del paziente per grave insufficienza cardiaca. Nell'EI subacuta, il processo di formazione dell'insufficienza valvolare (con un alto grado di rigurgito) è più lento - un mese o più. Morfologicamente, l'EI è descritta come poliposi-ulcerativa (Fig. 5.1, vedere riquadro). Con il regresso del processo infiammatorio-distruttivo le vegetazioni microbiche vanno incontro a fibrosi e calcificazione, ma anche in questo stadio sono possibili complicanze tromboemboliche o embolie da frammenti di vegetazioni calcificate.
Manifestazioni extracardiache dell'EI
Il decorso della malattia è caratterizzato infiammazione sistemica e intossicazione settica, spesso accompagnata da lesioni multiorgano extracardiache, di natura secondaria e associate allo sviluppo patologia da complessi immunitari O complicanze tromboemboliche, nonché infezioni metastatiche e setticemia.
Tornando alla teoria della “cascata settica”, è necessario chiarire che i suoi fattori scatenanti sono le endotossine di microrganismi gram-negativi e i lipopolisaccaridi cellulari di batteri e funghi gram-positivi. Stimolano il rilascio di mediatori infiammatori, come il fattore di necrosi tumorale, le interleuchine e le chinine. Questi mediatori danneggiano l'endotelio, favoriscono la stasi del sangue a livello dei capillari e agiscono come vasocostrittori o vasodilatatori, contribuendo alla formazione della sindrome infiammatoria sistemica.
Un’ampia gamma di lesioni extracardiache nell’EI è causata da meccanismi immunopatogenetici. L'ingresso massiccio di antigeni batterici nel sangue durante l'EI porta all'attivazione policlinale (stimolazione) dei linfociti B. Nella milza iperplastica si verifica la formazione attiva dei centri germinali, che corrisponde ai processi di proliferazione e
differenziazione dei linfociti B durante lo sviluppo di una risposta umorale timo-dipendente. L'attivazione del collegamento B è indicata anche da un aumento del numero di plasmacellule nel sangue e nel midollo osseo. Viene attivata anche la sintesi delle immunoglobuline, in particolare M. Gli anticorpi contro l'agente patogeno costituiscono circa il 15% degli anticorpi formati (Miller N., 1978). Tra gli altri, viene rilevato il fattore reumatoide, la crioglobulemia di tipo misto è osservata nel 90% dei pazienti con EI. Una conseguenza importante della produzione attiva di anticorpi è la formazione di complessi immuni circolanti (CIC), che vengono rilevati, secondo varie fonti, nel 50-100% dei pazienti affetti da EI. Tali manifestazioni extracardiache dell'EI come sierosite, vasculite cutanea e glomerulonefrite costituiscono la triade classica della patologia degli immunocomplessi. Nell'EI esistono inoltre i prerequisiti per il verificarsi sia di ipercoagulazione sistemica (attivazione del sistema di coagulazione da parte di endotossine batteriche, CEC e danno alle strutture valvolari) che di manifestazioni emorragiche.
La batteriemia + i cambiamenti nell'endotelio (cuore e vasi sanguigni) sono i prerequisiti per l'insorgenza dell'EI.
QUADRO CLINICO
I cardiologi incontrano più spesso l'IE primaria subacuta, il cui quadro clinico sarà descritto in maggiore dettaglio.
L’EI subacuta è una malattia polimorfica, che rende la diagnosi estremamente difficile. Le manifestazioni cliniche dell'EI rappresentano diverse combinazioni di sintomi:
Batteriemia e infiammazione sistemica;
Segni di endocardite;
Embolia periferica;
Lesioni vascolari e d'organo da immunocomplessi. La malattia può svilupparsi sullo sfondo della batteriemia dopo o durante
momento di estrazione di un dente, tonsillite, malattia respiratoria, foruncolosi, criminalità, tonsillectomia, cistoscopia, interventi ginecologici o senza motivo apparente in completa salute.
Caratterizzato da febbre di tipo sbagliato, che dura per settimane, anche durante il trattamento con dosi moderate di antibiotici, accompagnata da brividi che vanno dalla sensazione scioccante alla semplice
freddo, brividi sulla schiena. Se si sospetta l'EI, si consiglia la termometria ogni 3 ore durante il giorno, poiché si possono osservare "candele" di temperatura a breve termine. In alcuni pazienti affetti da EI, la temperatura può essere bassa o addirittura normale (pazienti con grave insufficienza circolatoria, glomerulonefrite cronica, insufficienza renale, pazienti anziani e senili).
Dopo l'ispezione: pelle pallida, eruzioni cutanee petecchiali emorragiche, emorragie subungueali. Nei pazienti non trattati a lungo termine si osserva un sintomo di "dita a tamburo", molto più spesso - i cosiddetti "occhiali da orologio" - convessità delle unghie sulle mani. Molto caratteristiche dell'EI sono le emorragie della piega anteriore della congiuntiva - macchie di Lukin - una sindrome quasi patognomonica dell'EI o della sepsi generalizzata. Raramente vengono rilevate estese emorragie nel tessuto adiposo sottocutaneo - macchie di Janevier e durante l'oftalmoscopia nel fondo - macchie di Roth. Sotto la pelle, soprattutto sulla superficie palmare delle mani, sono presenti noduli di Osler densi e viola, dolorosi al tatto. Il danno articolare è più comune sotto forma di artralgia o, raramente, di artrite a rapida evoluzione delle articolazioni medie e piccole delle estremità.
Con l'EI attiva, i pazienti sperimentano una rapida perdita di peso, talvolta di 4-6 kg a settimana (in assenza di un trattamento adeguato).
I sintomi “periferici” elencati dell’EI sono stati piuttosto rari negli ultimi anni, il che è associato all’inizio precoce del trattamento antibiotico per varie condizioni febbrili, inclusa l’EI. Tuttavia, dovrebbero essere ricercati con perseveranza, poiché la maggior parte di essi hanno un grande valore diagnostico per “febbri di origine sconosciuta”.
Il danno endocardico è il fattore principale nel quadro clinico dell’EI. Nel decorso subacuto primario della malattia, i segni di malattia cardiaca, molto spesso insufficienza aortica, compaiono già nella 3a settimana di malattia. Si comincia a sentire un soffio protodiastolico sull’aorta e nel punto di Botkin, che diventa più grossolano in un breve periodo di tempo. Il rumore si intensifica quando il paziente si piega in avanti, con le braccia alzate. Di solito compare anche un soffio sistolico, associato alla presenza di ampie vegetazioni sulle valvole. Quando si sviluppa un difetto aortico, i soffi possono comparire improvvisamente quando le valvole si perforano.
La comparsa di pressione arteriosa “aortica” (alta sistolica e bassa diastolica) può coincidere con un rapido sviluppo dell'insufficienza ventricolare sinistra (asma cardiaco, edema polmonare) con danno all'IE della valvola aortica. Significativamente prima rispetto ai difetti reumatici compaiono altri segni vascolari di insufficienza aortica: "danza carotidea", doppio tono di Traube, soffio di Vinogradov-Durozier, soffio di Flint. Tutti questi sintomi di solito accompagnano una grave distruzione della valvola aortica.
Quando la valvola mitrale è danneggiata, si verifica un nuovo soffio di rigurgito mitralico. Con vegetazioni relativamente grandi sulla valvola mitrale si può osservare un restringimento dell'orifizio mitralico, soprattutto nell'endocardite secondaria, dove si è già verificata una stenosi reumatica. Il soffio di rigurgito può diventare particolarmente forte quando un lembo viene strappato o si rompono le corde di una valvola cardiaca interessata.
Nella clinica dell'IE è la formazione di un difetto con un “nuovo” rumore di rigurgito valvolare.
In caso di EI secondaria sullo sfondo di una cardiopatia reumatica esistente, si presta attenzione alla rapida progressione della malattia cardiaca sullo sfondo di febbre alta.
La diagnosi di EI parietale, di ascessi valvolari e di fistole miocardiche purulente è particolarmente difficile. Molto spesso, l'endocardite parietale si verifica sullo sfondo dell'endocardite marantica negli anziani, con neoplasie maligne con metastasi e sullo sfondo della sepsi generalizzata. La diagnosi dell'endocardite murale e degli ascessi valvolari è migliorata significativamente con l'introduzione dell'ecocardiografia transesofagea nella pratica clinica.
Il danno miocardico in un modo o nell'altro viene rilevato morfologicamente in tutti i casi di EI, ma spesso non si osserva un quadro clinico dettagliato della miocardite, di solito nella cosiddetta variante "immunologica" della malattia. Con lo sviluppo precoce della miocardite, si verifica una rapida espansione delle cavità del cuore. Segni di insufficienza circolatoria (palpitazioni, mancanza di respiro, gonfiore delle gambe, attacchi d'asma) con un apparato valvolare relativamente intatto possono essere associati a miocardite. C'è ottusità dei suoni cardiaci, prolungamento PQ fino al blocco A-V completo, extrasistoli,
raramente - fibrillazione atriale. Nel sangue vengono rilevati alti livelli di LDH-1, CPK, MB-CPK e mioglobina.
Le lesioni pericardiche con un quadro clinico pronunciato nell'EI sono rare, sebbene durante l'ecocardiografia in molti pazienti venga rilevata una piccola pericardite essudativa (300-400 ml di liquido) che scompare rapidamente con la terapia antibatterica. A volte si può sentire uno sfregamento pericardico sopra lo sterno. Con gli ascessi miocardici si può sviluppare una pericardite essudativa purulenta, che aggrava bruscamente il decorso della malattia e può richiedere un trattamento chirurgico urgente.
Un segno frequente di EI, anche all'esordio della malattia, è il tromboembolismo (rene, milza, estremità e vasi mesenterici), accompagnato da complicazioni gravi, talvolta fatali. Il tromboembolismo delle arterie coronarie è raro, il che è associato alle peculiarità del riempimento delle arterie coronarie in diastole, ma nell'EI si verificano infarti miocardici embolici.
La tromboembolia è un segno comune di EI anche all'esordio della malattia.
Le lesioni vascolari sono molto caratteristiche dell'EI. Queste sono vasculiti cutanee, così come i nodi di Osler (vasculite con aneurisma di un vaso, vegetazione microbica in esso, successivo sviluppo di un microaneurisma vascolare, sua rottura). I nodi di Osler sono spesso localizzati sulla superficie palmare delle mani e delle gambe. Particolarmente pericolosi sono gli aneurismi micotici delle arterie dei vasi cerebrali con possibile rottura dell'aneurisma e lo sviluppo di un ictus con una clinica di paralisi improvvisa e coma cerebrale con esito fatale per tagli passanti, paralisi, disturbi del linguaggio a breve termine, eccetera.
Complicanze neurologiche (ictus embolici, emorragie subaracnoidee, ascessi cerebrali, ecc.) si osservano nel 5-19% dei casi di EI. Meningite purulenta, encefalite, tromboembolismo dell'arteria retinica centrale con cecità improvvisa sono rari.
Nell'EI sulla valvola tricuspide (di solito "endocardite dei tossicodipendenti") si osservano embolia polmonare, polmonite da infarto con emottisi, ascessi polmonari multipli e polmonite "settica" (Fig. 5.2, vedere riquadro).
Il fegato è spesso colpito nell'EI subacuta: infarti epatici con o senza dolore intenso e ittero
manifestazioni cliniche, epatite di origine tossica o immunologica. Il fegato è solitamente ingrossato, denso e doloroso. Le frazioni di bilirubina, transaminasi, fosfatasi alcalina aumentano, le frazioni proteiche cambiano. Il danno epatico può essere influenzato dalla terapia antibiotica (cefalosporine, vancomicina). In questo caso, la sospensione degli antibiotici porta ad una rapida normalizzazione della funzionalità epatica, ma la decisione di annullarli sullo sfondo dell'endocardite in corso pone sempre un problema terapeutico.
L'ingrossamento della milza è uno dei sintomi più importanti dell'EI, ma ci sono pazienti senza milza ingrossata. Infarti embolici si riscontrano spesso nel tessuto splenico e quindi i pazienti lamentano un dolore acuto nell'ipocondrio sinistro; talvolta con un infarto splenico si sviluppa una pleurite del lato sinistro ed è possibile la rottura spontanea della milza.
I danni alla milza e al fegato sono manifestazioni comuni dell'EI.
La glomerulonefrite da immunocomplessi era considerata classica per l'EI. Attualmente è meno comune ed è benigno. Di norma, con la cura dell'EI si verifica una guarigione o una remissione a lungo termine della glomerulonefrite. La glomerulonefrite subacuta (proliferativa extracapillare) con insufficienza renale irreversibile a rapida progressione, che si osserva raramente nell'EI (secondo i nostri dati, nel 2,3% dei pazienti), ha un significato prognostico sfavorevole. Anche l'aminoidosi dei reni si sviluppa raramente.
Quasi la metà dei pazienti con EI sviluppa sindromi sistemiche da complessi immunitari (sierosite, glomerulonefrite, artrite, miocardite)
In assenza di una terapia precoce adeguata per l’EI, di solito si verifica una generalizzazione del processo, che colpisce molti organi e sistemi.
FORME SPECIALI DI IE
Nell’ultimo decennio si sono diffuse “nuove” forme di IE. Si tratta dell'"endocardite dei tossicodipendenti" causata da stafilococchi o microflora gram-negativa. È grave e colpisce più spesso la valvola tricuspide (sebbene sia possibile
danno ad altre valvole), è complicato da tromboembolia polmonare, ascessi polmonari e spesso ha un decorso recidivante.
Tabella 5.3
Situazioni cliniche per sospettare un'endocardite infettiva
Le principali situazioni in cui sospettare l'IE: |
Febbre inspiegabile da più di 1 settimana + rumore di rigurgito (soprattutto nuovo). Febbre inspiegabile da più di 1 settimana + nuovi sintomi di insufficienza cardiaca. Febbre inspiegabile da più di 1 settimana + manifestazioni tipiche sulla pelle (noduli di Osler, macchie di Janevier) e congiuntiva (macchie di Lukin). Febbre inspiegabile + emocoltura positiva (con un agente patogeno caratteristico dell'EI). Febbre inspiegabile per più di 1 settimana in pazienti a rischio di EI (difetti cardiaci, protesi valvolari o altre strutture intracardiache, consumatori di droghe per iniezione). Febbre inspiegabile per più di 1 settimana associata a procedure recenti che possono causare batteriemia (l'intervallo tra la procedura e la comparsa della febbre è inferiore a 2 settimane). Sepsi di origine sconosciuta |
Situazioni particolari che sollevano il sospetto di IE: |
Tromboembolia di origine sconosciuta. Ictus inspiegabili o emorragia subaracnoidea nei giovani. Ascessi polmonari multipli nei tossicodipendenti. Ascessi periferici ad eziologia sconosciuta (ascessi renali, milza, corpi vertebrali, endoftalmite endogena). Febbre inspiegabile da più di 1 settimana + disturbi della conduzione atrioventricolare e ventricolare di nuova comparsa. Protesi valvolare + nuova disfunzione protesica |
Situazioni che richiedono la considerazione dell'IE in differenziale diagnosi |
Glomerulonefrite acuta o rapidamente progressiva. Febbre inspiegabile da più di 1 settimana + dolore lombare. Ematuria + mal di schiena, sospetto di infarto renale. Vasculite emorragica |
È stato identificato un ampio gruppo di endocarditi “nosocomiali” associate ad attività medica: endocarditi di protesi valvolari, con scarsa cura delle cannule endovenose durante le infusioni a goccia, con emodialisi cronica, con posizionamento di pacemaker artificiale, dopo bypass coronarico, ecc. L'intero gruppo di EI, solitamente causati da flora non streptococcica, è grave e difficile da trattare con antibiotici. Con lo sviluppo dell'ecocardiografia, l'endocardite nella cardiomiopatia ipertrofica e nell'EI murale ha cominciato a essere rilevata più spesso.
Il numero di pazienti affetti da EI in età avanzata e senile è aumentato in modo significativo. L'EI in questa fascia di età può essere in parte di natura nosocomiale.
La clinica dell'EI negli anziani e nei senili ha una serie di caratteristiche. Molto presto, a volte nelle prime settimane della malattia, l'insufficienza cardiaca progredisce e si osserva più spesso l'effetto cardiotossico degli antibiotici. La diagnosi di EI è difficile, poiché a questa età si verificano numerose malattie che si manifestano con febbre alta e intossicazione. Sono comuni le combinazioni dell'EI con queste malattie (endocardite e tumori del colon, del pancreas, endocardite e pielonefrite, endocardite e colite ulcerosa poliposa, EI e mieloma, EI e malattie linfoproliferative). In questo gruppo di pazienti si osservano più spesso complicanze tromboemboliche (dei vasi cerebrali), rotture di aneurismi micotici e stati psicotici.
Forme particolari di EI: nei tossicodipendenti (valvola tricuspide), su protesi valvolari, nell'emodialisi cronica, nell'anziano.
DIAGNOSTICA DI LABORATORIO
La diagnosi batteriologica è descritta in dettaglio nella sezione “Eziologia dell'EI”. Va sottolineato che un'emocoltura non rilevata non esclude la diagnosi di EI.
Nel sangue, il numero dei leucociti è spesso elevato, ma può essere normale. Nella formula dei leucociti si osserva uno spostamento di banda verso i mielociti. Una diminuzione del contenuto di emoglobina e di globuli rossi è caratteristica e ha un significato prognostico.
La VES è solitamente aumentata a 50-70 mm/ora, sebbene nei pazienti con difetti cardiaci congeniti di tipo "blu" con grave insufficienza cardiaca congestizia, talvolta con glomerulonefrite con grave insufficienza renale, la VES può essere normale o bassa. Possono verificarsi trombocitopenia o trombocitosi. La proteina C-reattiva è positiva, il cui livello riflette l'attività dell'IE. Il livello delle α2 e γ-globuline è aumentato. La reazione di Wasserman può essere falsa positiva e ciò crea alcune difficoltà diagnostiche.
Vengono rilevati livelli elevati di IgM e IgG, le frazioni del complemento C3 e C4 sono ridotte. Il livello di CEC è solitamente aumentato, ma con risultati terapeutici favorevoli si osserva una diminuzione.
Negli esami delle urine in caso di febbre alta - albuminuria, in caso di infarto renale - ematuria. Con lo sviluppo di glomerulonefrite diffusa - albuminuria persistente, cilindri ialini e granulari, eritrocituria con globuli rossi freschi e alterati. Potrebbe esserci una diminuzione della filtrazione glomerulare, un aumento dell'urea e della creatinina nel sangue.
Una emocoltura negativa non esclude la diagnosi di EI.
DIAGNOSTICA ECOCARDIOGRAFICA
Il principale metodo strumentale per la diagnosi di EI è l'esame ecocardiografico transtoracico o transesofageo. Il ruolo dell'ecocardiografia è quello di ricercare le vegetazioni, che solitamente sono formazioni ecopositive aggiuntive di varia forma, dimensione e densità, attaccate a valvole, corde o altre aree dell'endocardio, che solitamente galleggiano lungo il flusso e sono caratterizzate da elevata velocità e casualità del movimento (Fig. 5.3 (vedi riquadro), Fig. 5.4), valutando la disfunzione valvolare, identificando la diffusione dell'infezione oltre l'apparato valvolare.
Ecocardiografia transtoracica (TTE) raccomandato per tutti i pazienti con sospetta EI. L'identificazione di vegetazioni associate alla valvola o all'endocardio parietale riveste importanza diagnostica, soprattutto quando localizzate in luoghi tipici (lungo la traiettoria del flusso rigurgitato) o associate a materiale protesico impiantato senza altre caratteristiche anatomiche
Riso. 5.4. Ecocardiografia transtoracica in un paziente affetto da EI. Vegetazioni calcificate multiple (indicate dalle frecce) su tutti i lembi della valvola aortica
spiegazioni; ascessi o fistole intracardiaci; nuova insufficienza valvolare; nuovo difetto della protesi valvolare. Nell'EI, le valvole mitrale e aortica sono più spesso colpite, ma nei tossicodipendenti sono colpite la valvola tricuspide e, occasionalmente, la valvola polmonare.
Ecocardiografia transesofagea (TEE) ha una maggiore sensibilità nel rilevare vegetazioni e ascessi ed è indicato per EI di protesi valvolari, con risultato TTE negativo in pazienti con elevata probabilità clinica di EI e complicanze di EI.
TTE e TEE possono dare risultati falsi negativi se le vegetazioni sono piccole o si è verificata separazione della vegetazione con embolia. La capacità dell’ecocardiografia di predire la tromboembolia è limitata. Il rischio maggiore si verifica con vegetazioni mobili di grandi dimensioni (più di 10 mm) sul lembo mitralico anteriore.
Indicazioni per studi ecocardiografici ripetuti:
TEE dopo un TTE positivo in pazienti ad alto rischio di complicanze;
TEE 7-10 giorni dopo il primo TEE se l'IE rimane sospettata o se il decorso clinico è allarmante durante il trattamento precoce dell'EI. In alcuni casi, le vegetazioni si sono ingrandite e sono diventate visibili a questo punto, oppure possono diventare evidenti ascessi o fistole. Un aumento delle dimensioni delle vegetazioni in seguito a registrazioni ripetute, nonostante un'adeguata terapia antibatterica, è associato ad un aumento del rischio di complicanze e alla necessità di un intervento chirurgico;
peggioramento inspiegabile dei sintomi dell’insufficienza cardiaca, alterazione del soffio cardiaco, nuovo blocco atrioventricolare o aritmia;
L'esame ecocardiografico dinamico (con una frequenza di 10-14 giorni) consente di monitorare le dimensioni e la densità acustica della vegetazione e diagnosticare le complicanze. Durante il trattamento, la dimensione della vegetazione può diminuire fino a scomparire, mentre la densità acustica può aumentare man mano che si organizzano.
L'ecocardiografia è il metodo principale per individuare la vegetazione sulle valvole cardiache e le conseguenze distruttive dell'EI (perforazioni fogliari, rotture delle corde, fistole e ascessi).
CRITERI DI DIAGNOSI
La diagnosi di EI acuta si basa sull'identificazione dei sintomi di sepsi e dei segni di danno alla valvola cardiaca. La clinica per la sepsi è brillante e dimostrativa, il tasso di distruzione valvolare nell'EI acuta è elevato - 7-10 giorni, quindi di solito non si presentano problemi diagnostici importanti. Inoltre, nella maggior parte dei casi di EI acuta, è nota la “porta” dell’infezione.
I principali sintomi e segni di sepsi: febbre frenetica o costante (39-40 ° C) e oltre, accompagnata da brividi e sudorazione profusa; grave condizione generale del paziente a causa di intossicazione; sviluppo frequente della sindrome DIC; splenomegalia; setticopiemia; emocoltura positiva, spesso già sullo sfondo della terapia antibatterica iniziata; insufficienza vascolare; la presenza di una “porta” di infezione. Esami del sangue: anemia, VES bruscamente aumentata, leucocitosi con un forte spostamento a sinistra (ai mielociti), granulazione toxogenica, trombocitopenia. Può anche determinare
condividono uno stato di immunodeficienza, secondaria nella maggior parte dei casi, con diminuzione delle immunoglobuline, depressione del sistema T e alterata fagocitosi. L'esame ecografico rivela una distruzione in rapida progressione della valvola interessata e un elevato grado di rigurgito all'ecocolordoppler. Il processo potrebbe non essere limitato alle valvole; è possibile lo sviluppo di pericardite purulenta, ascessi e fistole purulente nel miocardio. Il decorso della malattia è chiaro ed evidente e, anche in assenza di sindromi da immunocomplessi periferici (sono meno frequenti nelle forme acute di EI), la diagnosi viene fatta abbastanza rapidamente. Non è necessario che un medico esperto faccia riferimento ai criteri diagnostici nei casi di EI acuta.
La diagnosi di EI acuta si basa sull'identificazione dei sintomi di sepsi e di danni alle valvole cardiache.
Al contrario, la diagnosi di EI subacuta è estremamente impegnativa. La malattia in questa variante è clinicamente polimorfica; i segni EchoCG (vegetazioni microbiche, rigurgito, distruzione valvolare, ecc.) possono essere assenti nelle prime 4-6 settimane di malattia. La fonte dell’infezione non è sempre evidente o difficile da associare al quadro clinico. Diverse sindromi di EI subacuta possono emergere e influenzare negativamente la direzione della ricerca diagnostica. Ad esempio, i sintomi della glomerulonefrite possono fungere da “maschera” renale per l’EI.
Di seguito sono riportati i criteri DUKE per l'IE (Duke Endocarditic Service, USA, 1994), adottati nei paesi di lingua inglese, la loro modifica proposta da V.P. Tyurin nel 2001, nonché i criteri per la diagnosi di EI subacuta, sviluppati presso il Dipartimento di Terapia della Facoltà dell'Università Medica Statale Russa nel 1992.
Si propone di prendere in considerazione la diagnosi di EI subacuta: "affidabile- quando si combinano 2 criteri clinici principali con 1 aggiuntivo e almeno 2 paraclinici; "probabile- quando si combinano 2 criteri principali, di cui uno è il rumore del rigurgito, con 1 ulteriore, anche in assenza di conferma paraclinica; "possibile- con una combinazione di criteri clinici e paraclinici di base e aggiuntivi, ma senza rumore di rigurgito e presenza di criteri ecocardiografici, mentre non sono escluse altre direzioni di ricerca diagnostica.
Tabella 5.4
Criteri diagnostici Duke IE (modificati da J. Li, approvati dall'American Heart Association nel 2005)
Alterazioni patologiche: vegetazioni o ascessi intracardiaci confermati dall'esame istologico che rivelano endocardite attiva.
B. Criteri clinici:
GRANDI CRITERI
o NASEKgroup O Staphylococcus aureus,
Endocardite infettiva certa |
A. Segni patomorfologici: Microrganismi identificati durante l'esame batteriologico o istologico di vegetazioni, emboli o campioni di ascessi intracardiaci, Alterazioni patologiche: vegetazioni o ascessi intracardiaci confermati dall'esame istologico che rivelano endocardite attiva. Per la diagnosi è sufficiente identificare uno dei criteri sopra indicati. B. Criteri clinici: due criteri maggiori, oppure uno maggiore e tre minori, oppure cinque criteri minori |
Possibile endocardite infettiva |
Un criterio maggiore e uno minore oppure tre criteri minori |
Esclusa endocardite infettiva |
Una chiara diagnosi alternativa per spiegare i sintomi della malattia, Scomparsa dei sintomi dell'endocardite infettiva durante il trattamento antibiotico in meno di 4 giorni, Assenza di evidenza patologica di endocardite infettiva in corso di intervento chirurgico o autoptico con terapia antibiotica da meno di 4 giorni, Criteri insufficienti per probabile endocardite infettiva sopra elencati |
Criteri clinici per l'endocardite infettiva |
GRANDI CRITERI |
1. Emocoltura positiva: Agenti patogeni tipici dell'EI isolati da due campioni di sangue separati: Streptococchi viridans, Streptococcus bovis, o NASEKgroup (Haemophilus spp., Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eirenella spp., Kingella kingae), O Staphylococcus aureus, o enterococchi acquisiti in comunità in assenza di un focus primario, |
Fine del tavolo. 5.4
agenti patogeni compatibili con EI isolati da un'emocoltura nelle seguenti condizioni: almeno due risultati positivi da campioni di sangue prelevati a distanza di almeno 12 ore l'uno dall'altro, o tre risultati positivi su tre, o la maggioranza dei risultati positivi da quattro o più campioni di sangue ( l'intervallo tra il primo e l'ultimo campione deve essere di almeno 1 ora), Rilevazione singola Coxiella burnetii o titolo IgG verso questo microrganismo >1:800. 2. Evidenza di danno endocardico: Risultati positivi dell'ecocardiografia transtoracica (transesofagea in presenza di protesi valvolari in pazienti con possibile EI secondo criteri clinici o identificazione di complicanze sotto forma di ascesso perivalvolare): vegetazione fresca sulla valvola o sulle sue strutture di supporto o materiale impiantato, oppure un ascesso o nuova disfunzione della protesi valvolare, Rigurgito valvolare di nuova formazione (l'aumento o la modifica del soffio cardiaco esistente non viene preso in considerazione) |
PICCOLI CRITERI |
Predisposizione: condizioni cardiache predisponenti o frequenti iniezioni endovenose (inclusa la dipendenza da droghe e l'abuso di sostanze). Temperatura corporea pari o superiore a 38°C. Fenomeni vascolari: embolia delle grandi arterie, infarti polmonari settici, aneurismi micotici, emorragie intracerebrali, emorragie nella piega transitoria della congiuntiva e lesioni di Janevier. Fenomeni immunologici: glomerulonefrite, noduli di Osler, macchie di Roth e fattore reumatoide. Evidenza microbiologica: un'emocoltura positiva che non soddisfa i criteri principali (escluse singole colture positive di stafilococchi coagulasi-negativi, solitamente Staphylococcus epidermidis e organismi non noti per causare EI) o conferma sierologica di un'infezione attiva dovuta a un potenziale agente causale di CIOÈ (Coxiella burnetii, Brucella, Clamidia, Legionella) |
Tabella 5.5
Criteri per la diagnosi di EI subacuta, sviluppati presso il Dipartimento di Terapia della Facoltà dell'Università Medica Statale Russa (1992)
Tabella 5.6
I criteri diagnostici di Duke modificati da V.P. Tiurin, 2001
Criteri di grandi dimensioni |
1. Emocoltura positiva da almeno 2 campioni di sangue separati, indipendentemente dal tipo di agente patogeno. 2. Segni EchoCG di EI: vegetazioni su valvole cardiache o strutture sottovalvolari, ascesso o disfunzione di una valvola protesica, insufficienza valvolare di nuova diagnosi |
Piccoli criteri |
1. Precedente malattia valvolare o dipendenza da droghe per via endovenosa. 2. Febbre superiore a 38 °C. 3. Sintomi vascolari: embolia arteriosa, infarto polmonare, aneurismi micotici, emorragie intracraniche, sintomo di Lukin. 4. Manifestazioni immunitarie: glomerulonefrite, noduli di Osler, macchie di Roth, fattore reumatoide. 5. Milza ingrossata. 6. Anemia. |
L'IE è considerato affidabile se: vengono presentati 2 criteri maggiori o 1 criterio maggiore e 3 minori o 5 criteri minori.
L'EI subacuta è caratterizzata da diversità clinica, che complica significativamente la diagnosi. L'uso di criteri diagnostici sistematizza la ricerca diagnostica.
Dal nostro punto di vista, la cosiddetta EI “probabile” consente di iniziare la terapia antibatterica. Va ricordato che l'associazione di sintomi quali febbre, vasculite, splenomogalia è caratteristica anche del LES, della vasculite sistemica, delle malattie linfoproliferative, e finché non viene rilevata la vera e propria lesione valvolare (endocardite) con soffio di rigurgito, la ricerca diagnostica deve continuare .
DIAGNOSI DIFFERENZIALE
La diagnosi differenziale dell’EI acuta non è molto difficile a causa dei chiari segni della malattia.
1. Il quadro clinico è dominato dalla sepsi stessa: febbre frenetica o monotonamente alta, grave intossicazione, setticopiemia, sindrome da coagulazione intravascolare disseminata, sintomi di shock tossico.
2. In questo contesto, appare un quadro clinico di progressiva distruzione valvolare con lo sviluppo di rigurgito di grandi volumi e grave insufficienza cardiaca.
3. Di norma, ci sono evidenti "porte di infezione" e un'emocoltura positiva viene nuovamente coltivata, anche quando viene iniziata la terapia antibatterica.
4. I cambiamenti del sangue sono caratteristici: anemia grave, forte aumento della VES, leucocitosi con spostamento a sinistra, granularità tossigena dei neutrofili, trombocitopenia. Si può anche determinare uno stato di immunodeficienza: diminuzione delle immunoglobuline, depressione del sistema T, fagocitosi.
In combinazione con i segni ecoCG di EI, che compaiono entro 1-2 settimane dalla malattia, la diagnosi di EI acuta diventa abbastanza affidabile nelle prime fasi della malattia, il che non esclude la sua prognosi severa.
L'EI acuta è la sepsi (“porta dell'infezione”, emocoltura) con rapida distruzione della valvola e sviluppo di insufficienza cardiaca.
L'EI subacuta, in quanto malattia con quadro clinico polimorfico, è invece molto difficile da diagnosticare precocemente. Di seguito sono riportate le principali malattie che richiedono la differenziazione dall'EI subacuta.
1. A causa dell’elevata prevalenza delle malattie linfoproliferative, la loro differenziazione dall’EI subacuta viene prima di tutto.
2. Nei pazienti con cardiopatia reumatica, la comparsa di febbre immotivata è spesso motivo di sovradiagnosi di EI. D'altra parte, insufficienza cardiaca progressiva, aumento della temperatura dopo infezioni respiratorie acute, comparsa dei cosiddetti positivi. I "test reumatici" hanno contribuito per molti anni alla sovradiagnosi della febbre reumatica in pazienti con una causa completamente diversa di sviluppo dei sintomi: IE secondaria, incluso lieve (protratto), tromboembolia di piccoli rami dell'arteria polmonare, ecc.
3. La diagnosi differenziale più difficile è l'EI con fenomeni immunitari (nefrite, sierosite, vasculite, miocardite) e il LES subacuto o cronico con sviluppo di valvulite - endocardite di Libman-Sachs. I sintomi paraclinici, ad eccezione dei segni EchoCG convincenti di EI, possono non essere informativi. I più convincenti e decisivi nella diagnosi sono i segni di un difetto cardiaco in rapido sviluppo con un grande volume di rigurgito e distruzione delle strutture valvolari e sottovalvolari nell'EI, cosa del tutto insolita per l'endocardite nel LES e altre malattie designate come malattie diffuse del tessuto connettivo.
4. Nelle persone anziane, è spesso necessario distinguere tra sintomi paraneoplastici febbrili e altri sintomi paraneoplastici (sierosite, vasculite) ed EI subacuta. Questo gruppo di pazienti può mostrare segni di patologia valvolare, il più delle volte calcificazione idiopatica delle strutture fibrose e valvolari. Astenia, anemia, VES accelerata, perdita di peso accompagnano varie malattie. La febbre è tipica del cancro dell’intestino, dei reni e del pancreas. Algoritmo differenziale
L'esame differenziale è nel piano della diagnostica approfondita dei processi oncologici della localizzazione specificata.
5. L'EI subacuta può svilupparsi sullo sfondo dell'immunopatologia: linfoma, paraproteinemia. Abbiamo osservato l'aggiunta di IE sullo sfondo del mieloma, del morbo di Crohn e dei linfomi. È possibile sviluppare endocardite da freccia durante processi oncologici di varie localizzazioni con successiva infezione.
Sulla base di quanto sopra, l'algoritmo di ricerca diagnostica raccomandato per uno stato febbrile di origine inspiegabile in pazienti con segni (o senza) di patologia valvolare dovrebbe concentrarsi sui segni clinici ed ecografici di EI: vegetazioni, distruzione, rumore di rigurgito, aumento dell'insufficienza cardiaca congestizia . Di grande importanza è la presenza di sindrome tromboembolica in accordo con la localizzazione dell'endocardite. Non si può escludere la prescrizione di antibiotici ad ampio spettro a scopo diagnostico nella diagnosi di EI “probabile”.
L'EI subacuta deve essere distinta dalle altre malattie febbrili (linfomi, tumori, malattie diffuse del tessuto connettivo).
TRATTAMENTO
Il trattamento dell’EI è difficile e per ogni singolo paziente ci sono molte incognite da risolvere. Soffermiamoci sui principi generali del trattamento dell'IE.
1. Nel trattamento dell'EI, utilizzare antibiotici battericidi e, se possibile, per via endovenosa, perché I microrganismi responsabili sono strettamente immersi nella fibrina della vegetazione, la vascolarizzazione delle valvole è scarsamente espressa e l'effetto soppressore delle infezioni è ottenuto solo dagli antibiotici battericidi.
2. È necessaria la prescrizione anticipata di antibiotici, mentre il processo è localizzato solo sulla valvola e non si è verificata la sua generalizzazione. Sfortunatamente, questa situazione richiede una diagnosi precoce dell’EI, che non è sempre possibile.
3. Gli antibiotici non dovrebbero essere prescritti prima della raccolta iniziale delle emocolture batteriologiche.
4. La scelta del regime terapeutico è determinata dall'agente eziologico isolato dell'EI. Se l'agente patogeno non viene identificato mediante emocoltura o è necessario l'inizio immediato della terapia, vengono utilizzati regimi terapeutici empirici.
5. Le dosi di antibiotici utilizzate devono essere quanto più tollerate possibile. È inaccettabile ridurre i dosaggi dopo aver ottenuto l'effetto iniziale durante il trattamento. Molto spesso, questa tattica porta alla resistenza alla terapia e alle ricadute precoci.
6. Il trattamento dell'EI dovrebbe essere a lungo termine, il periodo medio di utilizzo degli antibiotici è di 4-6 settimane dal momento in cui si ottiene l'effetto iniziale. Il calcolo dei giorni per la durata raccomandata del trattamento antibiotico dovrebbe iniziare il primo giorno in cui l’emocoltura diventa negativa. Se si sviluppa resistenza alla terapia può essere necessario cambiare farmaco, allungare il ciclo di trattamento o trasferire il paziente in una struttura di cardiochirurgia.
7. Il trattamento antibiotico dei pazienti con EI delle valvole naturali dopo l'intervento chirurgico con impianto di una valvola artificiale dovrebbe corrispondere ai regimi di trattamento per l'EI delle valvole protesiche. Se si ottiene la crescita di microrganismi dai tessuti rimossi, si raccomanda un ciclo completo di terapia antimicrobica dopo l'intervento chirurgico; se non vi è crescita, la durata del trattamento può essere ridotta del numero di giorni di trattamento per l’EI prima dell’intervento chirurgico.
Principi di selezione degli antibiotici
È più semplice selezionare un antibiotico per il trattamento dell’EI se si conosce l’agente patogeno e la sua sensibilità agli antibiotici. In condizioni reali, spesso non è possibile isolare rapidamente una vera emocoltura e non tutti i microrganismi isolati possono essere riconosciuti come veri agenti patogeni.
Per gli agenti patogeni streptococcici è meglio usare la penicillina fino a 20 milioni di unità. e più sale sodico al giorno o ampicillina 8-12 g, solitamente in combinazione con alcuni aminoglicosidi (gentamicina - 240 mg al giorno, netilmicina fino a 200 mg). Se tale combinazione risulta inefficace si possono utilizzare le cefalosporine: ceft-
riaxon - 2 g al giorno, fortum - 4-5 g al giorno, i farmaci di riserva sono thienam - 4 g al giorno, vancomicina fino a 2 g al giorno. Per l'EI causata da enterococchi resistenti agli antibiotici sopra menzionati (un problema terapeutico urgente!) si può utilizzare la teicoplanina.
Per l'EI causata da stafilococchi aurei e bianchi, i più utilizzati sono l'augmentina (amoxiclav) fino a 4-8 g al giorno, l'unasina, varie cefalosporine, soprattutto ceftriaxone e fortum; rifampicina fino a 0,9-1,2 g al giorno, tienam e vancomicina.
Microrganismi NASEK: ceftriaxone e fortum sono i più efficaci, si può usare la vancomicina.
La brucellosi e l'endocardite da clamidia sono sensibili al trattamento con doxaciclina, eritromicina, aminoglicosidi e clotrimazolo.
L'EI causata da funghi patogeni è molto grave. Per il trattamento vengono utilizzate l'amfotericina B e la 5-fluorocitosina, seguite dalla sostituzione della valvola. La prognosi per l'endocardite fungina è solitamente molto grave.
Se l'eziologia dell'endocardite è sconosciuta, il trattamento viene solitamente iniziato con una combinazione di ampicillina (8-12 g al giorno) e aminoglicosidi. Al posto dell'ampicillina si possono utilizzare le ureidopenicilline (azlocillina, piperacillina fino a 20 g al giorno).
Se il gruppo della penicillina è inefficace, vengono utilizzati cefalosporina (kefzol, fortum, ceftriaxone), tienam, ciprofloxacina, vancomicina, teicoplaxina.
La scelta della terapia per i pazienti con EI con emocoltura negativa è molto più difficile e la prognosi della malattia è peggiore rispetto a quella per EI con un patogeno noto.
Quando si sceglie un antibiotico si tiene conto di un'emocoltura nota; in caso di eziologia sconosciuta dell'EI, il trattamento inizia con una combinazione di ampicillina e aminoglicosidi.
Nella complessa terapia dell'EI, la terapia immunosostitutiva gioca un ruolo significativo: i complessi immunoglobulinici, utilizzati sotto forma di bolo o in un piccolo contagocce (100 ml) - Octogam, endobulina, aiutano a superare la resistenza dei microrganismi agli antibiotici. La plasmaferesi viene utilizzata anche come fattore aggiuntivo nella lotta contro antigeni batterici, tossine, ecc.
I glucocorticoidi sono usati raramente per trattare l'EI, poiché dopo un effetto positivo immediato, le recidive di endocardite sono molto più comuni. Inoltre i glucocorticoidi, pur riducendo l’eventuale febbre, non consentono una valutazione oggettiva dell’effetto dell’antibiotico. Tuttavia, con l'EI possono verificarsi situazioni che richiedono l'uso del prednisolone: condizioni di emergenza - shock batterico, quando prednisolone o desametasone vengono somministrati per via endovenosa, con intolleranza allergica agli antibiotici, nonché con sindromi immunologiche (miocardite, nefrite, vasculite, artrite). In questo caso, il prednisolone viene prescritto dopo aver ottenuto l'effetto iniziale della terapia antibatterica e viene interrotto anche 1-1,5 settimane prima della fine del trattamento antibiotico.
Metodi chirurgici di trattamento
Di seguito sono riportate le indicazioni per il trattamento chirurgico.
1. Protesi di valvola infetta per EI acuta e subacuta causata da un'infezione altamente virulenta resistente alla terapia antibiotica (batteriemia persistente con emocoltura positiva una settimana dopo l'inizio del trattamento antibiotico). Questo è l'unico modo per salvare la vita di questi pazienti.
2. Insufficienza cardiaca progressiva causata dal rapido sviluppo della distruzione valvolare.
3. EI causata da agenti patogeni inizialmente resistenti alla terapia antimicrobica (funghi patogeni, Pseudomonas aeruginosa, ecc.).
4. Endocardite della protesi. In un certo numero di pazienti, l'endocardite della protesi può essere curata con antibiotici senza intervento chirurgico (O.M. Butkevich, V.P. Tyurin, D. Kays, ecc.).
5. Ascessi miocardici, ascessi dell'anello valvolare, fistole miocardiche purulente.
6. Vegetazioni grandi (più di 10 mm), sciolte e mobili sulle corde, rotture dei lembi, minaccia di tromboembolia negli organi vitali.
Dal punto di vista della prognosi del trattamento chirurgico, si raccomanda di trasferire il paziente in remissione instabile utilizzando la terapia antibatterica e quindi operare. Non dobbiamo dimenticare anche l'endocardite postoperatoria della protesi valvolare.
PREVENZIONE
Sembra appropriato l'uso profilattico obbligatorio di brevi cicli di antibiotici in soggetti ad aumentato rischio di sviluppare EI durante procedure terapeutiche o diagnostiche che possono causare batteriemia (vedi sotto). 30 minuti-1 ora prima delle manipolazioni si somministrano 1.000.000 di unità di penicillina o 2 g di oxacillina (mapicillina) per 1-3 giorni oppure si utilizzano altri schemi (Tabella 5.3).
Il rischio di sviluppare EI nella patologia cardinale è presentato come segue.
Malattie con alto rischio Connessioni IE:
Valvole cardiache protesiche (compresi trapianti biologici);
Difetti cardiaci congeniti complessi di tipo “cianotico” (anche dopo correzione chirurgica);
Precedentemente soffriva di endocardite infettiva;
Vasi sistemici o polmonari formati chirurgicamente. Malattie con rischio medio Connessioni IE:
Difetti cardiaci valvolari acquisiti;
Difetti cardiaci congeniti di tipo “non cianotico”, inclusa la valvola aortica bicuspide (è escluso il difetto del setto interatriale secondario);
Prolasso della valvola mitrale con grave rigurgito o significativo ispessimento della valvola (degenerazione mixomatosa);
Cardiomiopatia ipertrofica. Malattie con a basso rischio Connessioni IE:
Difetto del setto interatriale secondario;
Dopo intervento chirurgico di legatura del dotto arterioso pervio e riparazione del difetto interatriale;
Prolasso della valvola mitrale senza rigurgito;
Dopo un intervento chirurgico di bypass dell'arteria coronaria;
Dopo l'impianto di un pacemaker;
Con soffi cardiaci funzionali.
La prevenzione è raccomandata per i pazienti con un rischio alto e moderato di sviluppare EI, durante interventi odontoiatrici sul parodonto, pulizia preventiva di denti o impianti, durante tonsille o adenoidectomie, broncoscopia con broncoscopio rigido, operazioni sulle vie biliari o sull'intestino, interventi su la ghiandola prostatica, cistoscopia.
Nei soggetti ad aumentato rischio di sviluppare EI (difetti cardiaci, protesi valvolari, pregressa EI), si raccomanda l'uso profilattico di antibiotici durante le procedure diagnostiche e terapeutiche accompagnate da batteriemia (interventi chirurgici, cistoscopia, ecc.)
Per interventi medici nel cavo orale, nelle vie respiratorie, nell'esofago (la profilassi antibatterica è mirata principalmente contro gli streptococchi del gruppo viridans e del gruppo NASEK): In assenza di allergia alla penicillina: amoxicillina 2 g (bambini 50 mg/kg) per via orale 1 ora prima della procedura; amoxicillina o ampicillina 2 g (bambini 50 mg/kg) per via endovenosa nell'arco di 30-60 minuti. prima della procedura se è impossibile assumere il farmaco per via orale; Per le allergie alla penicillina: clindamicina 600 mg (bambini 20 mg/kg) o azitromicina o claritromicina 500 mg (bambini 15 mg/kg) 1 ora prima della procedura, o cefalexina 2 g (bambini 50 mg/kg) per via orale 1 ora prima della procedura. procedura |
Durante le procedure mediche sugli organi genito-urinari o sul tratto gastrointestinale, la profilassi antibatterica è mirata agli enterococchi, Streptococcus bovis, Enterobatteriacee: Se non sei allergico alla penicillina: Per i pazienti ad alto rischio: amoxicillina o ampicillina 2 g per via endovenosa + gentamicina 1,5 mg/kg per via endovenosa in 30-60 minuti. prima della procedura, dopo 6 ore amoxicillina o ampicillina 1 g per via orale o ampicillina 1 g EV o IM; Per i pazienti a rischio medio: amoxicillina o ampicillina 2 g (bambini 50 mg/kg) IM o IV nell'arco di 30-60 minuti. prima della procedura o amoxicillina 2 g (per i bambini 50 mg/kg) per via orale 1 ora prima della procedura. Se sei allergico alla penicillina: Per i pazienti ad alto rischio: vancomicina 1 g (bambini 20 mg/kg) per via endovenosa 1-2 ore prima della procedura + gentamicina 1,5 mg/kg per via endovenosa o intramuscolare; Per i pazienti a rischio medio: vancomicina 1 g (bambini 20 mg/kg) per via endovenosa 1-2 ore prima della procedura |