Meccanismi periferici del dolore. Meccanismi nervosi del dolore. Per localizzazione del dolore
Le idee moderne sul funzionamento dei meccanismi del dolore e dell'analgesia si basano su dati provenienti da studi anatomici, morfologici, neurofisiologici e biochimici. Tra questi si possono distinguere due principali direzioni scientifiche. Il primo comprende lo studio della natura anatomica e delle proprietà fisiologiche dei substrati neuronali che trasmettono gli impulsi nocicettivi. La seconda direzione è associata allo studio dei meccanismi fisiologici e neurochimici nelle singole strutture cerebrali sotto vari tipi di influenze che portano al sollievo dal dolore (Kalyuzhny, 1984).
La percezione del dolore è assicurata da un complesso sistema nocicettivo, che comprende un gruppo speciale di recettori periferici e neuroni centrali situati in molte strutture del sistema nervoso centrale e che rispondono agli effetti dannosi (Khayutin, 1976; Limansky, 1986; Revenko et al. , 1988; La Motte et al., 1982; Meyer et al., 1985; Torebjork, 1985; Szoicsanyi, 1986).
Recettori del dolore.
Esistono vari tipi di nocicettori che controllano l'integrità del funzionamento di organi e tessuti e rispondono anche a improvvise deviazioni nei parametri degli ambienti interni del corpo. Nella pelle predominano i meccanocettori A-δ monomodali e i nocicettori C polimodali; si trovano anche nocicettori A-δ e C bimodali (termici e meccanorecettori) (Cervero, 1985; Limansky, 1986; Revenko, 1988).
È generalmente accettato che i sistemi afferenti somatici e viscerali differiscano nelle loro proprietà. Le fibre A-δ del sistema nocicettivo afferente somatico trasmettono informazioni sensoriali organizzate somaticamente, che in varie parti del cervello sono sottoposte ad analisi spaziotemporale e vengono percepite come dolore localizzato acuto o lancinante. Nelle fibre C del sistema nocicettivo afferente somatico è codificata l'intensità dell'azione di uno stimolo nocicettivo, che provoca una sensazione di dolore diffuso, bruciante, difficile da sopportare (secondario) e determina le complesse forme motivazionali ed emotive del comportamento ad esso associato (Zhenilo, 2000).
L'attivazione dei recettori del sistema nocicettivo afferente viscerale di solito si manifesta in reazioni autonomiche ed è caratterizzata da un aumento del tono muscolare, dallo sviluppo di uno stato di ansia, sensazioni di dolore sordo e diffuso (viscerale), spesso complicato da dolore riferito alla pelle aree (Cervero, 1985; 1987; Zilber, 1984; Zhenilo, 2000).
Pertanto, i nocicettori svolgono un ruolo significativo nella formazione della risposta al dolore. Tuttavia, indipendentemente da quali siano i meccanismi con cui si verificano le informazioni nocicettive nella periferia, i processi che si verificano nel sistema nervoso centrale sono di fondamentale importanza nella formazione del dolore. È sulla base dei meccanismi centrali: convergenza, somma, interazione dei sistemi mielinizzati veloci e non mielinizzati lenti a diversi livelli del sistema nervoso centrale che la sensazione e la colorazione qualitativa del dolore vengono create sotto l'azione di vari stimoli nocicettivi (Kalyuzhny, 1984 ; Mikhailovich, Ignatov, 1990; Bragin, 1991; Price, 1999).
Partecipazione del midollo spinale nella trasmissione degli impulsi dolorifici.
Il primo collegamento centrale che percepisce le informazioni afferenti multimodali è il sistema neuronale del corno dorsale del midollo spinale. Si tratta di una struttura citoarchitettonica molto complessa, che in termini funzionali può essere considerata come una sorta di centro integrativo primario delle informazioni sensoriali (Mikhailovich, Ignatov, 1990; Waldman et al., 1990).
Secondo i dati di A.V. Valdman e Yu.D. Ignatov (1990), gli interneuroni convergenti del corno dorsale del midollo spinale, la maggior parte dei quali hanno proiezioni ascendenti, rappresentano la prima stazione per la commutazione degli impulsi nocicettivi e sono direttamente coinvolti nella generazione di informazioni di tale qualità che dalle parti superiori del cervello vengono considerate dolorose e innescano complessi meccanismi di risposta al dolore. Tuttavia, attualmente ci sono tutte le ragioni per credere che l'attività dei neuroni relè associati all'afferenza nocicettiva, le loro risposte agli stimoli multimodali, l'interazione di vari input afferenti su di essi e, di conseguenza, la formazione di un flusso di impulsi ascendente siano modulati dai neuroni della sostanza gelatinosa (Rethelyi et al., 1982; Dubner, Bennett, 1983; Bicknell, Beal, 1984; Dubner et al., 1984; Perl, 1984; Iggo et al., 1985). Dopo un'elaborazione molto complessa dell'afferenza del dolore nell'apparato segmentale del midollo spinale, dove è influenzato da influenze eccitatorie e inibitorie provenienti dalle parti periferiche e centrali del sistema nervoso, gli impulsi nocicettivi vengono trasmessi attraverso gli interneuroni alle cellule della parte anteriore e corna laterali, che causano reazioni motorie e autonomiche riflesse. Un'altra parte degli impulsi eccita i neuroni, i cui assoni formano percorsi ascendenti.
Vie ascendenti degli impulsi dolorifici.
Le informazioni nocicettive che entrano nel corno dorsale del midollo spinale entrano nel cervello attraverso due sistemi afferenti ascendenti “classici”: lemniscale ed extralemniscale (Martin, 1981; Chignone, 1986). All'interno del midollo spinale, uno di essi si trova nella zona dorsale e dorsolaterale della sostanza bianca, l'altro nella sua parte ventrolaterale. Si nota inoltre che nel sistema nervoso centrale non esistono percorsi specializzati di sensibilità al dolore e l’integrazione del dolore avviene a vari livelli in base alla complessa interazione delle proiezioni lemniscali ed extralemniscali (Kevetter, Willis, 1983; Ralston, 1984; Willis, 1985 ; Mikhailovich, Ignatov, 1990; Bernard, Besson, 1990).
Il sistema ventrolaterale è suddiviso nei tratti spinotalamico, spinoreticolare e spinomesencefalico. Il tratto spinotalamico è un importante percorso ascendente che esiste per trasmettere un'ampia gamma di informazioni sulle proprietà di uno stimolo doloroso ed è indicato come tratto neospinotalamico, mentre gli altri due sono combinati nel tratto paleospinotalamico (Willis et al., 2001). ; 2002).
I neuroni del tratto spinotalamico sono divisi in quattro gruppi: primo, neuroni ad ampio range dinamico o multirecettivi; il secondo: neuroni ad alta soglia (nocicettivi-specifici); terzo: soglia bassa; il quarto sono i neuroni profondi attivati da vari stimoli propriocettivi. I terminali dei neuroni del tratto spinotalamico terminano nei nuclei specifici (relè) del talamo (nucleo ventroposteriolaterale), nonché nell'associativo diffuso (parte mediale del complesso posteriore) e non specifico (complesso intralaminare - nucleo submediale) nuclei. Inoltre, un certo numero di assoni diretti al nucleo ventroposteriolaterale emettono collaterali nel nucleo centrolaterale, nonché neuroni della formazione reticolare mediale e della materia grigia centrale (Ma et al., 1987; Giesler, 1995; Willis et al ., 2001; 2002).
La maggior parte dei terminali delle fibre afferenti nocicettive viscerali terminano sui neuroni multirecettori del tratto spinotalamico, che ricevono anche informazioni dalle afferenze nocicettive somatiche, il che ci consente di considerarli come un importante sistema nocicettivo afferente in grado di trasmettere segnali causati dall'azione di stimoli meccanici con un un’ampia gamma di energie (Bushnell et al., 1993; Zhenilo, 2000).
Una quantità significativa di informazioni nocicettive entra nel tronco encefalico attraverso gli assoni del tratto spinoreticolare, che è la seconda via più grande per la trasmissione di informazioni nocicettive, i cui terminali sono distribuiti nella formazione reticolare mediale del midollo allungato, così come nel relè nuclei del talamo (Chignone, 1986). Alcuni neuroni spinoreticolari contengono encefalina (Mikhailovich e Ignatov, 1990). I neuroni spinoreticolari hanno piccoli campi recettivi cutanei e sono attivati sia da stimoli non nocicettivi che nocicettivi, e la frequenza delle loro scariche aumenta con l'aumentare dell'intensità della stimolazione.
Il tratto spinomesencefalico è formato da assoni e neuroni che si trovano insieme ai neuroni del tratto spinomesencefalico e li accompagnano all'istmo del mesencefalo, dove i terminali del tratto spinomesencefalico sono distribuiti tra strutture integrative che formano riflessi di orientamento e controllano le reazioni autonomiche, così come le strutture coinvolte nella comparsa di risposte avversive. Alcuni assoni del tratto spinomesencefalico formano collaterali nei nuclei ventrobasale e mediale del talamo. Attraverso questo sistema vengono attivati complessi riflessi antinocicettivi somatici e viscerali (Willis et al., 2001; 2002).
Il tratto spinocervicotalamico è formato prevalentemente da neuroni a bassa soglia e multirecettivi e trasporta informazioni sull'azione degli stimoli meccanici, non dolorosi e termici (Brown, 1981; Downie et al., 1988).
I principali conduttori attraverso i quali vengono trasmesse le informazioni viscerali afferenti provenienti dagli interocettori sono i nervi vago, splancnico e pelvico (Kerr, Fukushima, 1980). Le proiezioni propriospinali e proprioreticolari, insieme al tratto paleospinotalamico, sono coinvolte nella trasmissione del dolore sordo e scarsamente localizzato e nella formazione delle manifestazioni autonomiche, endocrine e affettive del dolore (Yaksh e Hammond, 1990).
Esiste una chiara distribuzione somatotopica di ciascun canale afferente, indipendentemente dal fatto che appartenga al sistema somatico o viscerale. La distribuzione spaziale di questi conduttori è determinata dal livello di ingresso sequenziale nel midollo spinale (Cervero, 1986; Zhenilo, 2000).
Pertanto, si possono distinguere diverse proiezioni ascendenti, che differiscono significativamente nell'organizzazione morfologica e sono direttamente correlate alla trasmissione delle informazioni nocicettive. Tuttavia, in nessun caso possono essere considerati come percorsi esclusivamente per il dolore, poiché sono anche i principali substrati degli input sensoriali in varie strutture cerebrali di altre modalità. Moderni studi morfologici e fisiologici e un'ampia pratica di interventi neurochirurgici indicano che le informazioni nocicettive raggiungono le parti superiori del cervello attraverso numerosi canali ridondanti che, a causa dell'ampia convergenza e delle proiezioni diffuse, coinvolgono nella formazione del dolore una complessa gerarchia di varie strutture cerebrali in cui l'interazione di sistemi afferenti multimodali (Mikhailovich, Ignatov, 1990).
Il ruolo del cervello nella formazione della risposta al dolore.
L'analisi dei dati della letteratura indica che durante la stimolazione dolorosa il flusso nocicettivo si trasmette dal midollo spinale a quasi tutte le strutture del cervello: i nuclei della formazione reticolare, la sostanza grigia periacqueduttale centrale, il talamo, l'ipotalamo, le formazioni limbiche e la corteccia cerebrale, che svolge un'ampia varietà di funzioni come il supporto sensoriale, motorio e autonomo delle reazioni protettive che si verificano in risposta alla stimolazione nocicettiva (Durinyan et al., 1983; Gebhart, 1982; Fuchs, 2001; Fuchs et al. , 2001; Guiibaud, 1985; Limansky, 1986; Ta, Mayakova, 1988; Mikhailovich, Ignatov, 1990; Bragin, 1991). Tuttavia, in tutte le aree del cervello si nota un'ampia convergenza e interazione dei sistemi afferenti somatici e viscerali, il che suggerisce l'unità fondamentale dei meccanismi centrali di regolazione della sensibilità al dolore (Waldman, Ignatov, 1990; Kalyuzhny, 1991). Allo stesso tempo, le proiezioni ascendenti diffuse trasmettono informazioni nocicettive a molte formazioni di diversi piani del cervello, che svolgono un'ampia varietà di funzioni, sia sensoriali, motorie e di supporto autonomo delle reazioni protettive che si verificano in risposta all'irritazione nocicettiva (Fuchs et al. al., 2001; Guilboud et al., 1987; Ta, Mayakova, 1988).
Nel talamo si possono distinguere tre principali complessi nucleari direttamente correlati all'integrazione del dolore: il complesso ventrobasale, il gruppo posteriore dei nuclei, i nuclei mediale e intralaminare. Il complesso ventrobasale è la struttura principale del sistema somatosensoriale, la cui convergenza multisensoriale sui neuroni fornisce informazioni somatotopiche accurate sulla localizzazione del dolore, sulla sua correlazione spaziale e sull'analisi sensoriale-discriminativa (Guilboud et al., 1987). I nuclei talamici, insieme al complesso ventrobasale, sono coinvolti nella trasmissione e valutazione delle informazioni sulla localizzazione del dolore e, in parte, nella formazione delle componenti motivazionale-affettive del dolore.
I nuclei mediale e intralaminare del talamo, che, insieme agli input nocicettivi, ricevono un massiccio afflusso afferente dalla materia grigia centrale dell’ipotalamo, dai sistemi limbico e striopallidale e hanno estese proiezioni sottocorticali e corticali, svolgono un ruolo fondamentale nell’integrazione di “ secondario”, dolore protopatico. Questi nuclei formano anche complesse reazioni difensive vegetomotorie alla nocicezione altamente integrate, nonché manifestazioni motivazionali e comportamentali del dolore e della sua percezione affettiva e fastidiosa (Cheng, 1983).
La corteccia cerebrale è coinvolta sia nella percezione del dolore che nella sua genesi (Porro e Cavazzuti, 1996; Casey, 1999; Ingvar e Hsieh, 1999; Treede et al., 2000; Churyukanov, 2003). La prima area corticale somatosensoriale S1 è direttamente coinvolta nei meccanismi di formazione della componente percettivo-discriminativa della reazione dolorifica sistemica; la sua rimozione porta ad un aumento delle soglie di percezione del dolore (Rainville et al., 1997; Bushnell et al., 1999 ; Petrovic et al., 2000; H Di Bauer et al., 2001). La seconda area somatosensoriale della corteccia, S2, è di primaria importanza nei meccanismi di formazione di adeguate reazioni protettive dell'organismo in risposta alla stimolazione dolorosa; la sua rimozione porta ad una diminuzione delle soglie di percezione. La regione orbitofrontale della corteccia gioca un ruolo significativo nei meccanismi di formazione della componente emotivo-affettiva della reazione dolorifica sistemica del corpo; la sua rimozione non modifica le soglie per la percezione della componente percettivo-discriminativa e aumenta significativamente la soglie per la percezione della componente emotivo-affettiva del dolore (Reshetnyak, 1989). Studi che utilizzano la tomografia ad emissione di positroni in combinazione con la risonanza magnetica nucleare hanno rivelato cambiamenti significativi nel flusso sanguigno e nel metabolismo locale nei campi corticali durante le influenze nocicettive (Talbot et al., 1991; Jones e Derbyshire, 1994).
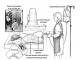
I dati di studi morfologici sullo studio delle connessioni intracerebrali utilizzando vari metodi (trasporto assonale retrogrado della perossidasi di rafano, degenerazione, immunoradiologico, istochimico, ecc.) sono presentati in Fig. 2.5. (Bragin, 1991).
Pertanto, la reazione al dolore “è una funzione integrativa del corpo, che mobilita un'ampia varietà di sistemi funzionali per proteggere il corpo da fattori dannosi e comprende componenti come coscienza, sensazioni, memoria, motivazione, reazioni vegetative, somatiche e comportamentali, emozioni " (Anokhin, Orlov, 1976).
Dolore- una complessa sensazione psico-emotiva spiacevole, formata sotto l'influenza di uno stimolo patogeno e come risultato della comparsa di disturbi organici o funzionali nel corpo, realizzata da uno speciale sistema di sensibilità al dolore e da parti superiori del cervello legate al sfera psico-emotiva. Il dolore non è solo un fenomeno psicofisiologico speciale, ma anche il sintomo più importante di molte malattie e processi patologici di diversa natura, che ha un significato di segnalazione e patogeno. Il segnale del dolore garantisce la mobilitazione del corpo per la protezione contro un agente patogeno e la limitazione protettiva della funzione dell'organo danneggiato. Il dolore è un compagno costante e la componente più importante della vita umana. Il dolore è l'acquisizione più preziosa dell'evoluzione del mondo animale. Forma e attiva varie reazioni protettive e adattive, garantisce il ripristino dell'omeostasi disturbata e la sua conservazione. Non c’è da stupirsi che esista un’espressione popolare: “Il dolore è il cane da guardia del corpo e della salute”. Tuttavia, il dolore è spesso una componente della patogenesi di vari processi patologici, partecipa alla formazione di “circoli viziosi”, contribuisce alla gravità della malattia e può esso stesso essere causa di disturbi del sistema nervoso centrale, strutturali e funzionali cambiamenti e danni agli organi interni. Esistono meccanismi di formazione del dolore (sistema nocicettivo) e meccanismi di controllo della sensazione di dolore (sistema antinocicettivo). Secondo le visioni moderne, il dolore si verifica a causa della predominanza dell'attività del sistema nocicettivo (algogenico) sull'attività del sistema antinocicettivo (antialgogenico), che funziona costantemente in un corpo sano. La sensazione di dolore si forma a diversi livelli del sistema nocicettivo: dalle terminazioni nervose sensoriali che percepiscono il dolore alle vie e alle strutture nervose centrali. Si presume che esistano speciali recettori del dolore, nocicettori, attivati sotto l'influenza di stimoli specifici, algogeni (chinine, istamina, ioni idrogeno, ACh, sostanza P, CA e PG in alte concentrazioni).
Gli stimoli nocicettivi vengono percepiti:
Terminazioni nervose libere in grado di registrare gli effetti di vari agenti come dolore;
Nocicettori specializzati: terminazioni nervose libere che vengono attivate solo dall'azione di specifici agenti nocicettivi e algogeni;
Terminazioni nervose sensibili di varie modalità: meccano-, chemio-, termocettori, ecc., esposte a influenze estremamente forti, spesso distruttive.
Anche effetti estremamente forti sulle terminazioni nervose sensoriali di altre modalità possono causare dolore.
L'apparato di conduzione del sistema nocicettivo è rappresentato da varie vie nervose afferenti che trasmettono impulsi con la partecipazione delle sinapsi dei neuroni nel midollo spinale e nel cervello. La trasmissione degli impulsi afferenti al dolore viene effettuata con la partecipazione di tratti nervosi come spinotalamico, lemniscale, spinoreticolare, spinomesencefalico, proprioreticolare, ecc.
L'apparato centrale per la formazione della sensazione di dolore comprende la corteccia cerebrale del prosencefalo (la prima e la seconda zona somatosensoriale), nonché l'area motoria della corteccia cerebrale, le strutture del talamo e dell'ipotalamo.
La sensazione di dolore è controllata da meccanismi neurogenici e umorali che fanno parte del sistema antinocicettivo. I meccanismi neurogeni del sistema antinocicettivo sono forniti da impulsi provenienti dai neuroni della materia grigia dell'ippocampo, del tegmento, dell'amigdala, della formazione reticolare, dei singoli nuclei cerebellari, che inibiscono il flusso ascendente delle informazioni del dolore a livello delle sinapsi nelle corna dorsali del midollo spinale e nuclei del rafe medio del midollo allungato (nucleo del rafe magnus). I meccanismi umorali sono rappresentati dai sistemi oppioidergico, serotoninergico, noradrenergico e GABAergico del cervello. I meccanismi neurogeni e umorali del sistema antinocicettivo interagiscono strettamente tra loro. Sono in grado di bloccare gli impulsi dolorifici a tutti i livelli del sistema nocicettivo: dai recettori alle sue strutture centrali.
Distinguere epicritico E dolore protopatico.
Epicritico(“veloce”, “primo”) Dolore si verifica a causa dell'influenza di sostanze irritanti di bassa e media intensità sulle formazioni recettoriali della pelle e delle mucose. Questo dolore è acuto, di breve durata e l'adattamento ad esso si sviluppa rapidamente.
Protopatico(“lento”, “doloroso”, “lungo”) Dolore avviene sotto l’influenza di stimoli forti, “distruttivi”, “su larga scala”. La sua fonte sono solitamente i processi patologici negli organi e nei tessuti interni. Questo dolore è sordo, doloroso, persiste a lungo ed è di natura più diffusa rispetto al dolore epicritico. L'adattamento ad esso si sviluppa lentamente o non si sviluppa affatto.
Il dolore epicritico è il risultato degli impulsi del dolore che salgono lungo la via talamocorticale fino ai neuroni delle aree somatosensoriali e motorie della corteccia cerebrale e della loro eccitazione, formando sensazioni soggettive di dolore. Il dolore protopatico si sviluppa come risultato dell'attivazione principalmente dei neuroni del talamo e delle strutture ipotalamiche, che determina la risposta sistemica del corpo allo stimolo doloroso, comprese le componenti autonomiche, motorie, emotive e comportamentali. Solo il dolore combinato, protopatico ed epicritico consente di valutare la localizzazione del processo patologico, la sua natura, gravità e scala.
Secondo il significato biologico distinguere tra dolore fisiologico e patologico.
Dolore fisiologico caratterizzato da un'adeguata risposta del sistema nervoso, in primo luogo, agli stimoli che irritano o distruggono i tessuti e, in secondo luogo, a influenze potenzialmente pericolose, e quindi avvertono del pericolo di ulteriori danni.
Dolore patologico caratterizzato da una risposta inadeguata del corpo all'azione di uno stimolo algogenico, che si verifica a causa della patologia delle parti centrali e periferiche del sistema nervoso. Questa reazione si forma durante l'afferenza del dolore in assenza di una parte del corpo o si verifica in risposta all'azione di fattori psicogeni.
Le ragioni principali per la formazione del dolore patologico di origine periferica:
Processi infiammatori cronici;
L'effetto dei prodotti di degradazione dei tessuti (nelle neoplasie maligne);
Danno cronico (compressione da cicatrici) e rigenerazione dei nervi sensoriali, demielinizzazione e alterazioni degenerative delle fibre nervose, che le rendono altamente sensibili alle influenze umorali (adrenalina, K +, ecc.), alle quali non rispondono in condizioni normali;
La formazione di neurinomi - formazioni da fibre nervose ricoperte in modo caotico, le cui terminazioni sono eccessivamente sensibili a varie influenze esogene ed endogene.
Livelli e fattori di danno che portano alla formazione di dolore patologico di origine periferica: eccessiva irritazione dei nocicettori; danno alle fibre nocicettive; danno ai gangli spinali (iperattivazione dei neuroni); danno alle radici dorsali.
Una caratteristica della patogenesi del dolore patologico di origine periferica è che la stimolazione nocicettiva dalla periferia può causare un attacco di dolore se supera il “gate control” nelle corna dorsali del midollo spinale, costituito dall'apparato di neuroni inibitori del Sostanza rolandica (gelatinosa), che regola il flusso di entrata nelle corna dorsali e la stimolazione nocicettiva ascendente. Questo effetto si verifica con un'intensa stimolazione nocicettiva o con insufficienza dei meccanismi inibitori di “gate control”.
Il dolore patologico di origine centrale si manifesta con iperattivazione dei neuroni nocicettivi a livello spinale e sopraspinale (corna dorsali del midollo spinale, nucleo caudale del nervo trigemino, formazione reticolare del tronco encefalico, talamo, corteccia cerebrale.
I neuroni iperattivati formano generatori di eccitazione patologicamente potenziata. Quando si forma un generatore di eccitazione patologicamente aumentata nelle corna dorsali del midollo spinale, si verifica una sindrome dolorosa centrale di origine spinale, nei nuclei del nervo trigemino - nevralgia del trigemino, nei nuclei del talamo - sindrome dolorosa talamica, ecc. .
Il generatore che nasce nell'input afferente (corna dorsali del midollo spinale o nucleo caudale del nervo trigemino) da solo non è in grado di causare dolore patologico. Solo quando nel processo sono coinvolte le parti superiori del sistema di sensibilità al dolore (talamo, formazione reticolare del tronco encefalico, corteccia cerebrale), il dolore si manifesta come sindrome, come sofferenza. Quella parte del sistema nocicettivo, sotto l'influenza della quale si forma il dolore patologico, svolge il ruolo di determinante primario. Dalle modificazioni primarie e secondarie del sistema della sensibilità al dolore si forma e si consolida una nuova integrazione patologica attraverso i processi plastici del sistema nervoso centrale: il sistema algico patologico. Formazioni di sistema nocicettivo alterato a vari livelli costituiscono il tronco principale del sistema algico patologico. I livelli di danno al sistema nocicettivo responsabile della formazione del sistema algico patologico sono presentati nella Tabella 27.
Tabella 27
Livelli e formazioni di un sistema nocicettivo alterato, che costituiscono la base del sistema algico patologico
| Livelli di danno al sistema nocicettivo | Strutture del sistema nocicettivo alterato |
| Dipartimenti periferici | Nocicettori sensibilizzati, focolai di eccitazione ectopica (nervi danneggiati e in rigenerazione, aree demielinizzate dei nervi, neuroma); gruppi di neuroni iperattivati dei gangli spinali |
| Livello spinale | Aggregati di neuroni iperattivi (generatori) nei relè nocicettivi afferenti - nelle corna dorsali del midollo spinale e nei nuclei del tratto spinale del nervo trigemino (nucleo caudale) |
| Livello sopraspinale | Nuclei della formazione reticolare del tronco cerebrale, nuclei del talamo, corteccia sensomotoria e orbitofrontale, strutture emotiogene |
Secondo la patogenesi, esistono tre tipi principali di sindromi dolorose: somatogena, neurogena, psicogena.
Sindromi dolorose somatogene si verificano a seguito dell'attivazione dei recettori nocicettivi durante e dopo l'infortunio, con infiammazione dei tessuti, tumori, varie lesioni e malattie degli organi interni. Si manifestano con lo sviluppo di dolore più spesso epicritico, meno spesso protopatico. Il dolore viene sempre percepito nell'area del danno o dell'infiammazione, ma può estendersi oltre.
Sindromi dolorose neurogene derivano da un danno significativo alle strutture periferiche e (o) centrali del sistema nocicettivo. Sono caratterizzati da una variabilità significativa, che dipende dalla natura, dal grado e dalla posizione del danno al sistema nervoso. Lo sviluppo di sindromi dolorose neurogene è causato da disturbi morfologici, metabolici e funzionali nelle strutture del sistema nocicettivo.
Sindromi dolorose psicogene derivano da un significativo stress psico-emotivo in assenza di disturbi somatici pronunciati. Il dolore psicogeno si manifesta spesso con lo sviluppo di mal di testa e dolori muscolari ed è accompagnato da emozioni negative, stress mentale, conflitti interpersonali, ecc. Il dolore psicogeno può verificarsi sia nei disturbi funzionali (nevrosi isterica, depressiva) che organici (schizofrenia e altri tipi di psicosi) del sistema nervoso interno.
Tipi speciali di sindromi dolorose cliniche includono causalgia e dolore fantasma. Causalgia– dolore bruciante parossistico e intensificante nell’area dei tronchi nervosi danneggiati (solitamente facciale, trigemino, sciatico, ecc.). Dolore fantasma si forma nella coscienza come sensazione soggettiva di dolore nella parte mancante del corpo e si verifica a causa dell'irritazione delle estremità centrali dei nervi tagliati durante l'amputazione.
Altri tipi di dolore includono dolore proiettato, irradiato, riferito e mal di testa. Il dolore di proiezione si avverte nella parte periferica del nervo, quando la sua parte centrale (prossimale) è irritata. Il dolore riferentesi si verifica nell'area di innervazione di un ramo del nervo in presenza di un focolaio di irritazione nell'area di innervazione di un altro ramo dello stesso nervo. Il dolore riferito si verifica in aree della pelle innervate dallo stesso segmento del midollo spinale degli organi interni in cui si trova la fonte del danno. Le cefalee sono molto diverse per natura, tipo, forma, intensità, durata, gravità, localizzazione e coinvolgono reazioni sia somatiche che autonomiche. Sono causati da diversi disturbi della circolazione cerebrale e sistemica, disturbi nell'apporto di ossigeno e substrato al cervello, nonché varie lesioni.
Il dolore in condizioni di patologia prolungata agisce come un importante fattore patogenetico nello sviluppo di processi patologici e malattie.
Nella pratica medica moderna, ai fini del sollievo dal dolore, vengono utilizzati approcci volti a ridurre l'attività del sistema nocicettivo e ad aumentare l'attività dei sistemi antinocicettivi. A questo scopo vengono utilizzati la terapia del dolore etiotropica, patogenetica e sintomatica e i seguenti metodi di riduzione del dolore:
Farmacologico (vengono utilizzate l'anestesia locale, generale e combinata);
Psicologico (suggestione, autoipnosi, ipnosi, ecc.);
Fisico (elettroagopuntura, elettronarcosi, elettroforesi, correnti diadinamiche, cerotti di senape, massaggi);
Viene effettuato un intervento chirurgico (immobilizzazione delle ossa durante le fratture, riduzione delle lussazioni, rimozione di tumori, calcoli biliari o renali, asportazione di cicatrici del tessuto connettivo, in caso di dolore intollerabile prolungato, coagulazione di strutture e fibre nervose - fonte di afferenza del dolore) fuori.
Ogni persona sa per esperienza personale che molte irritazioni di diversa natura possono diventare dolorose non appena la loro intensità raggiunge determinati limiti. Allo stesso tempo, in un certo numero di organi e sistemi ci sono punti (o in generale tale caratteristica è caratteristica di un dato organo o sistema nel suo insieme) che sono indolori, nel senso che la causa più comune di dolore è la lesione meccanica - non è in grado di provocare dolore, non importa quanto intenso sia, non c'è stato alcun impatto. È noto, ad esempio, che la dissezione della parete delle singole sezioni del tratto gastrointestinale è completamente indolore, così come i traumi meccanici (chirurgici) all'utero, al cuore, ecc. Ciò però non significa che questi organi non possano essere fonte di dolore. L'accumulo di prodotti sottoossidati nel miocardio durante l'ischemia, lo stiramento degli organi digestivi cavi, lo spasmo del dotto biliare comune o degli ureteri possono diventare fonte di forte dolore.
A questo proposito, la maggior parte dei ricercatori tende a isolare i recettori del dolore specializzati: nocicettori.
I nocicettori includono recettori ad alta soglia che si eccitano quando esposti a forti stimoli. Ciò vale principalmente per le terminazioni nervose libere delle fibre non mielinizzate di tipo C, nonché per le fibre mielinizzate di tipo A δ. Si presuppone inoltre che anche le fibre nervose del tipo A α e A β possano partecipare alla percezione e alla trasmissione dell'informazione dolorosa. I nocicettori si dividono in meccanocicettori(rispondere con eccitazione principalmente all'influenza meccanica: colpo, iniezione, spostamento improvviso del tessuto, ecc.) e chemocitocettori(eccitato quando esposto a sostanze chimiche formate nella zona danneggiata).
E le fibre δ e le fibre C conducono gli impulsi nervosi a velocità diverse e percepiscono impulsi di frequenze diverse per la conduzione. A questo proposito si distinguono due tipi di dolore: epicritico (veloce) e protopatico (lento). La rapida conduzione di una sensazione di dolore localizzato è associata all'attivazione delle fibre A δ e alla sensazione non localizzata di dolore intenso con le fibre C. Il dolore epicritico consente non solo di valutare rapidamente l'effetto del fattore dannoso, ma anche di determinarne la localizzazione, e quindi il dolore epicritico viene talvolta chiamato avvertimento (fisiologico) Dolore.
Viene chiamato dolore protopatico, dovuto al fatto che i suoi segnali ricordano costantemente al corpo che c'è un danno ricordante (patologico).
È risaputo che somatico(cioè proveniente dalla pelle, dai muscoli, dalle articolazioni, dalle ossa, ecc.) il dolore differisce nella natura delle sensazioni dal dolore viscerale(cioè proveniente dagli organi interni). È ormai accertato che i sistemi del dolore viscerale e somatico sono costruiti su un unico principio e le differenze tra loro riguardano principalmente la densità di innervazione per unità di area e la composizione delle fibre.
Parlando dei meccanismi periferici del dolore, è necessario rispondere alla domanda: qual è l'irritante diretto dei recettori del dolore?
Molti ricercatori sul dolore credono che tutto nocicettivo gli stimoli hanno una proprietà comune in relazione ai tessuti biologici: interrompono la respirazione dei tessuti. COSÌ P. K. Anokhin scrive: “Ovunque il processo porta ad un cambiamento e, ovviamente, anche all’asfissia delle terminazioni nervose libere, alla fine sorge una sensazione dolorosa”.
Questa affermazione, a nostro avviso, è alquanto controversa, poiché sono note condizioni in cui si nota una grave asfissia, ma non si avverte alcuna sensazione di dolore. Ad esempio, con l'edema polmonare cardiaco, quando si osservano sia ipossia che ipercapnia, il paziente avverte soffocamento, ma non una sensazione di dolore generalizzato, come sarebbe dovuto accadere se la posizione espressa da P.K. Anokhin fosse comunque corretta. La situazione è senza dubbio molto più complicata, soprattutto da quando sono state scoperte sostanze che lo hanno algogenico (doloroso) azione, tra gli effetti biologici di cui è assente l'asfissia (cioè ipossia più ipercapnia).
Tra le sostanze biologicamente attive spetta la priorità in termini di effetto algogenico istamina, la cui somministrazione sottocutanea, anche in concentrazioni trascurabili (10 -18 g/ml), provoca nei soggetti una netta sensazione di dolore. A mediatori del dolore(sostanze che si formano nell'area del danno e stimolano i recettori del dolore), oltre all'istamina, includono anche chinine, serotonina, acetilcolina, catecolamine, sale calcio E potassio Svolgono anche un ruolo importante nella formazione di una reazione dolorosa olistica. prostaglandine, renina, ossitocina. Anche alte concentrazioni hanno un effetto doloroso. acido lattico.
introduzione
La conoscenza del meccanismo cellulare di trasmissione e modulazione dell'informazione nocicettiva può essere utile:
1) per una migliore comprensione della farmacologia dei farmaci analgesici noti;
2) sviluppare indicazioni per la creazione di nuovi analgesici.
Concetti neurofisiologici di base
Il dolore può essere distribuito lungo le fibre A-delta e C del nocicettore e in base all'intensità dell'attivazione del nocicettore (meccanismo del dolore periferico). In determinate condizioni, il dolore può essere trasmesso attraverso le fibre A-beta quando l'eccitabilità dei meccanorecettori a bassa soglia viene attivata dalla stimolazione tattile. Responsabili di questo fenomeno sono i cambiamenti nelle proprietà funzionali del secondo neurone (il meccanismo centrale del dolore).
Meccanismo del dolore periferico
Una soglia di attivazione elevata richiede un’intensa stimolazione patologica per attivare il “sistema di allarme” e aumentare la sensibilità al dolore. In situazioni in cui gli stimoli patologici causano danni ai tessuti e lo sviluppo di una risposta infiammatoria di accompagnamento, le fibre sottili mielinizzate e non mielinizzate possono sensibilizzarsi. A questo proposito, la soglia per la loro attivazione diminuisce, il recettore innesca scariche di frequenza più elevata o può anche avere un'attività spontanea.
Tali cambiamenti nelle proprietà conduttive del nocicettore si sviluppano in connessione con la comparsa di sostanze chimiche prodotte nel sito della lesione, dove spesso si osserva infiammazione (sostanze algogene). Il recettore può essere attivato da stimoli di minore intensità. Il fenomeno della “sensibilizzazione periferica” è responsabile di un aumento della sensibilità al dolore, che alla fine porta ad un aumento dell’intensità del dolore con stimolazione della stessa forza (iperalgesia).
Meccanismo centrale del dolore
La stimolazione prolungata o ripetuta può alterare le proprietà di risposta dei neuroni del corno dorsale (plasticità neuronale). I neuroni del corno dorsale possono sensibilizzarsi e rispondere con uno stimolo più forte dopo che l’impulso è passato (il fenomeno dell’“armamento”).
In determinate condizioni, alcuni neuroni nel corno dorsale possono diventare sensibili anche alla stimolazione non patologica attraverso le fibre A-beta a bassa soglia, così che anche il tocco leggero può diventare doloroso (allodinia).
Tale ipersensibilità può essere considerata una condizione patologica, poiché il dolore in questo caso non è un segnale protettivo sui disturbi del corpo. La stimolazione a bassa intensità può causare e prolungare un dolore lancinante. In alcuni pazienti, il dolore spontaneo può svilupparsi senza una ragione apparente.
Dolore patologico
Quali disturbi del SNC causati da stimoli patologici prolungati e intensi possiamo trattare o, meglio ancora, prevenire? La natura dei cambiamenti nei neuroni delle corna dorsali causati da un’intensa stimolazione è lungi dall’essere completamente compresa. Tuttavia, alcuni meccanismi di effetti farmacologici mirati sui processi di sensibilizzazione sono stati definiti abbastanza chiaramente.
Woolf et al. ha dimostrato che il secondo neurone del corno dorsale è coinvolto nella formazione del tratto spinotalamico (via ascendente per le informazioni patologiche), che viene attivato dagli aminoacidi eccitatori (AAC). Il più studiato a questo proposito è il glutammato. BAK, come i neurotrasmettitori, può attivare vari recettori: NMDA (n-metil-d-aspartato), AMPA e QA (alfa-ammino-3-idrossi-5-metilisossazolo-5-proprionato e quisqualato) e recettori metabotropici (1,3 -trans -1-amminociclopentil-1,3-disarbossilato (transAPCD)).
Parliamo innanzitutto del recettore NMDA. In condizioni fisiologiche, l'attivazione dell'NMDA promuove la produzione di cGMP (guanosina monofosfato ciclico). In condizioni patologiche, la raffica di impulsi generati da una stimolazione patologica prolungata e intensa può sovrastimolare il recettore NMDA e innescare una cascata di reazioni intracellulari che aumentano la produzione di NO (ossido nitrico).
In caso di sovrapproduzione, l’NO può diffondersi fuori dalla cellula in cui è stato prodotto e diventare tossico per altre cellule che non hanno NO sintasi e altri meccanismi protettivi intracellulari. Si presume che l'NO in alte concentrazioni (come prodotto della superstimolazione del recettore NMDA da parte di aminoacidi eccitatori) possa agire su piccoli interneuroni encefalinergici che bloccano l'ingresso di informazioni nocicettive (“gate control”). A questo proposito, un'intensa stimolazione patologica non è controllata dai neuroni del corno dorsale, il che provoca iperalgesia.
Il background teorico sopra presentato consente di applicare nuovi approcci farmacologici all'analgesia:
1) il primo livello, l'attivazione del recettore NMDA, può essere bloccato dalla ketamina o dal MK 801 (+)-5-metil-10,11-diidro-5H dibenzo(a,d)cicloeptene-5,10-imina maleato );
2) il secondo livello, la produzione di NO nella cellula, può essere bloccato sostituendo la L-arginina con L-NAME (N-nitpo-L-arginina metil estere). La L-arginina è un substrato utilizzato dalla NO sintasi per produrre NO. Sostituirlo con L-NAME blocca questa reazione e impedisce un'ulteriore produzione di NO;
3) il terzo livello riguarda l'effetto centrale dei farmaci antinfiammatori non steroidei (FANS).
I FANS non hanno solo un'attività antinfiammatoria nella periferia, dove si verifica il danno tissutale, ma hanno anche una certa attività analgesica centrale. Questa attività è stata studiata a livello dei neuroni sensibilizzati del corno dorsale. Oltre ai recettori NMDA, i neuroni delle corna dorsali contengono recettori AMPA e recettori metabotropici, che svolgono un ruolo nell’effetto centrale dei FANS. Entrambi questi gruppi di recettori possono essere attivati da aminoacidi eccitatori, il che porta ad un aumento della produzione di prostaglandine nelle cellule del corno dorsale. I FANS attraversano facilmente la barriera emato-encefalica e possono produrre un effetto analgesico centrale attraverso diversi percorsi possibili, uno dei quali è il blocco della sintesi delle prostaglandine nei neuroni del corno dorsale.
Ketamina
A livello dei recettori NMDA, la ketamina e l'MK 801 vengono utilizzati come antagonisti dei recettori. Il recettore NMDA è un complesso piuttosto complesso con vari centri di interazione. La ketamina, essendo il suo antagonista incompleto, si lega al recettore nel centro del fenociclide. MK 801 non è ancora disponibile per uso clinico.
Esiste molta letteratura metodologica sull’uso degli antagonisti NMDA nella modellizzazione del dolore negli animali. In un lavoro recente, Meller e Gebhart hanno dimostrato che gli antagonisti NMDA riducono l'iperalgesia nei ratti indotta da un'intensa stimolazione termica. L'autore ha studiato i parametri comportamentali nei ratti durante la modellazione del dolore neuropatico. È stato notato che la ketamina può ridurre alcune, ma non tutte, le risposte nocicettive associate all’iperalgesia. Questo effetto può essere invertito mediante la somministrazione di NMDA. In clinica, la ketamina viene utilizzata con un certo successo per alleviare il dolore postoperatorio, il dolore fantasma e la nevralgia posterpetica. La maggior parte degli studi clinici hanno utilizzato una miscela racemica di ketamina e hanno osservato un aumento degli effetti psicomimetici. Oue et al. hanno suggerito che un’analgesia più efficace con minori effetti collaterali potrebbe essere ottenuta con l’uso della forma S della ketamina.
L-NOME
(N-nitro-L-arginina metil estere)
Meller e Gebhart hanno dimostrato che l'iperalgesia nei ratti indotta dalla somministrazione intratecale di NMDA (1 rmol/L) era ridotta quando venivano trattati con L-NAME. Lo studio dell'autore ha dimostrato che L-NAME, utilizzato per trattare il dolore neuropatico modello nei ratti, ha modificato i parametri comportamentali nella fase di iperalgesia di questa sindrome. L'effetto antinocicettivo di L-NAME viene eliminato dalla somministrazione di L-arginina o NMDA, poiché questi due mediatori ripristinano il comportamento nocicettivo negli animali. L-NAME non è adatto all'uso clinico, ma gli esperimenti sugli animali indicano una nuova direzione per un possibile intervento farmacologico nella neurochimica del dolore.
Antifiammatori non steroidei
I neuroni nocicettivi del corno dorsale sono attivati da aminoacidi eccitatori (EAA), che agiscono come neurotrasmettitori. Per neutralizzare gli effetti del VAK, il corpo produce un antagonista endogeno del BAK: l'acido kaynurenico. Si ritiene che, in determinate condizioni, alcuni FANS (ma non tutti) siano in grado di aumentare la produzione di acido kainurenico. Pertanto, si sviluppa un blocco a livello dei recettori VAC. Questo è solo uno dei possibili meccanismi per lo sviluppo dell’effetto analgesico centrale dei FANS. Questo effetto non dipende dal grado di blocco della sintesi delle prostaglandine. Gli effetti spinali dei FANS sono stati dimostrati da Malberg e Yaksh nei ratti. Qualche tempo prima, De Voghel aveva utilizzato la somministrazione epidurale di acido lisina acetilsalicilico con buoni risultati in pazienti affetti da dolore da cancro.
Conclusione
Il termine "dolore" dovrebbe cessare di esistere, poiché esistono molti tipi di dolore con diverse fisiopatologie. La terapia deve essere adattata alle esigenze specifiche di ciascun tipo di dolore. Anche la comparsa del dolore patologico è un processo dinamico che riflette i cambiamenti adattativi nel sistema nervoso centrale. Alcuni farmaci analgesici hanno un effetto protettivo a questo riguardo e possono essere utilizzati per l'analgesia preventiva.
Bibliografia
1. C.J. Woolf. Nuova strategia per il trattamento del dolore infiammatorio: prevenzione ed eliminazione della sensibilizzazione centrale // Farmaci. - 1994. -Vol. 47, supplemento 5.
2. S.T. Meller, G.B. Gebhart. Medatori spinali dell'iperalgesia // Farmaci. - 1994. -Vol. 47, supplemento 5.
3. A.B. Malmberg, T.L. Yaksh. Iperalgesia mediata dal glutammato spinale o dal recettore della sostanza P bloccato dall'inibizione della cicloossigenasi spinale // Scienza. - 1992. -Vol. 257.
4. I. Oye, O. Hustveit, A. Maurset, E. Ratti Moberg, O. Paulsen L.F. Skoglund. Le forme chirali di ketamina come sonde per la funzione del recettore NMDA negli esseri umani. Agenti correlati ai recettori NMDA // Biochimica, farmacologia e comportamento / Ed. di Tsutomu Kameyama, Toshitaka Nabeshima, Edward F. Domino. - Libri NPP, 1991.
5. D.T. Monagham, RJ. Ponti, C.W. Cotmann. Il recettore degli aminoacidi eccitatori: loro classi, farmacologia e proprietà distinte la funzione del sistema nervoso centrale // Pharmacol. Tossico. - 1989. -Vol. 29. - P. 365-402.
6. B.M. Barone, B.L. Harrison, F.P. Miller, I.M. McDonald, F.G. Salituro, C.J. Schmidt, S.M. Sorensen, H.S. Bianco, M.G. Palfreyman. Attività dell'acido 5,7-diclorocinurenico, un potente antagonista nel sito di legame della glicina associato al recettore N-metil-D-aspatato / Società americana di farmacologia e terapeutica sperimentale // Farmacologia molecolare. - 1990. -Vol. 38. - R. 554-561.
Il dolore e il sollievo dal dolore rimangono sempre i problemi più importanti della medicina e alleviare la sofferenza di una persona malata, alleviare il dolore o ridurne l'intensità è uno dei compiti più importanti di un medico. Negli ultimi anni sono stati compiuti alcuni progressi nella comprensione dei meccanismi di percezione e formazione del dolore. Restano però ancora molte questioni teoriche e pratiche irrisolte.
Il dolore è una sensazione spiacevole realizzata da uno speciale sistema di sensibilità al dolore e da parti superiori del cervello legate alla sfera psico-emotiva. Segnala effetti che provocano danni tissutali o danni preesistenti derivanti dall'azione di fattori esogeni o dallo sviluppo di processi patologici.
Si chiama il sistema di percezione e trasmissione dei segnali del dolore nocicettivo sistema (nocere-danno, cepere-percepire, lat.).
Classificazione del dolore. Evidenziare fisiologico e patologico Dolore. Il dolore fisiologico (normale) si verifica come una reazione adeguata del sistema nervoso a situazioni pericolose per l'organismo e in questi casi funge da fattore di allarme su processi potenzialmente pericolosi per l'organismo. Tipicamente, il dolore fisiologico è quello che si verifica nell'intero sistema nervoso in risposta a stimoli dannosi o distruttivi dei tessuti. Il principale criterio biologico che distingue il dolore patologico è il suo significato disadattivo e patogeno per il corpo. Il dolore patologico è prodotto da un sistema di sensibilità al dolore alterato.
Per natura si distinguono acuta e cronica dolore (costante). In base alla localizzazione si distinguono la pelle, la testa, il viso, il cuore, il fegato, lo stomaco, i reni, l'articolazione, la zona lombare, ecc .. Secondo la classificazione dei recettori, la superficie ( esterocettivo), profondo ( propriocettivo) e viscerale ( interocettivo) Dolore.
Ci sono dolori somatici (durante processi patologici nella pelle, nei muscoli, nelle ossa), nevralgici (solitamente localizzati) e vegetativi (solitamente diffusi). Possibile cosiddetto irradiante Dolore. Ad esempio, nel braccio sinistro e nella scapola per l'angina pectoris, nei cingoli per la pancreatite, nello scroto e nella coscia per le coliche renali. Secondo la natura, l'andamento, la qualità e le sensazioni soggettive del dolore, il dolore si distingue in parossistico, costante, fulmineo, diffuso, sordo, irradiante, tagliente, lancinante, bruciante, pressante, schiacciante, ecc.
Sistema nocicettivo.
Il dolore, essendo un processo riflesso, comprende tutti i principali collegamenti dell'arco riflesso: recettori (nocicettori), conduttori del dolore, formazioni del midollo spinale e del cervello, nonché mediatori che trasmettono gli impulsi del dolore.
Secondo i dati moderni, i nocicettori si trovano in grandi quantità in vari tessuti e organi e hanno molti rami terminali con piccoli processi assoplasmatici, che sono strutture attivate dal dolore. Si ritiene che siano terminazioni nervose essenzialmente libere e non mielinizzate. Inoltre, nella pelle, e soprattutto nella dentina dei denti, sono stati scoperti peculiari complessi di terminazioni nervose libere con cellule di tessuto innervato, considerati complessi recettori della sensibilità al dolore. Una caratteristica sia dei nervi danneggiati che delle terminazioni nervose libere non mielinizzate è la loro elevata chemiosensibilità.
È stato stabilito che qualsiasi impatto che porta a danno tissutale ed è adeguato per il nocicettore è accompagnato dal rilascio di agenti chimici algogenici (che causano dolore). Esistono tre tipi di tali sostanze.
a) tessuto (serotonina, istamina, acetilcolina, prostaglandine, ioni K e H);
b) plasma (bradichinina, callidina);
c) rilasciato dalle terminazioni nervose (sostanza P).
Sono state proposte numerose ipotesi sui meccanismi nocicettivi delle sostanze algogene. Si ritiene che le sostanze contenute nei tessuti attivino direttamente i rami terminali delle fibre non mielinizzate e causino un'attività impulsiva nelle afferenze. Altri (prostaglandine) stessi non causano dolore, ma aumentano l'effetto degli effetti nocicettivi con modalità diverse. Altre ancora (la sostanza P) vengono rilasciate direttamente dai terminali ed interagiscono con i recettori localizzati sulla loro membrana e, depolarizzandola, provocano la generazione di un flusso nocicettivo pulsato. Si presuppone inoltre che la sostanza P, contenuta nei neuroni sensoriali dei gangli dorsali, agisca anche come trasmettitore sinaptico nei neuroni del corno dorsale del midollo spinale.
Gli agenti chimici che attivano le terminazioni nervose libere sono considerate sostanze non completamente identificate o prodotti di distruzione dei tessuti che si formano sotto forti influenze dannose, durante l'infiammazione o durante l'ipossia locale. Le terminazioni nervose libere vengono attivate anche da un'intensa azione meccanica, provocandone la deformazione per compressione dei tessuti, stiramento dell'organo cavo con simultanea contrazione della sua muscolatura liscia.
Secondo Goldscheider, il dolore non deriva dall'irritazione di particolari nocicettori, ma dall'eccessiva attivazione di tutti i tipi di recettori delle varie modalità sensoriali, che normalmente rispondono solo a stimoli non dolorosi, “non nocicettivi”. Nella formazione del dolore in questo caso
l'intensità dell'impatto, così come la relazione spazio-temporale delle informazioni afferenti, la convergenza e la somma dei flussi afferenti nel sistema nervoso centrale sono di primaria importanza. Negli ultimi anni sono stati ottenuti dati molto convincenti sulla presenza di nocicettori “non specifici” nel cuore, nell’intestino e nei polmoni.
È ormai generalmente accettato che i principali conduttori della sensibilità al dolore cutaneo e viscerale siano le sottili fibre A-delta mielinizzate e le fibre C non mielinizzate, che differiscono per una serie di proprietà fisiologiche.
Oggi è generalmente accettata la seguente suddivisione del dolore:
1) primario: dolore leggero, breve, latente, ben localizzato e qualitativamente determinato;
2) secondario: dolore scuro, latente da tempo, scarsamente localizzato, doloroso, sordo.
È stato dimostrato che il dolore “primario” è associato agli impulsi afferenti nelle fibre A-delta e il dolore “secondario” è associato alle fibre C.
Vie ascendenti della sensibilità al dolore. Esistono due principali sistemi “classici”: il sistema ascendente lemniscale ed extralemniscale. All'interno del midollo spinale, uno di essi si trova nella zona dorsale e dorsolaterale della sostanza bianca, l'altro nella sua parte ventrolaterale. Non esistono percorsi specializzati per la sensibilità al dolore nel sistema nervoso centrale e l’integrazione del dolore avviene a vari livelli del sistema nervoso centrale sulla base della complessa interazione delle proiezioni lemniscali ed extralemniscali. Tuttavia, è stato dimostrato che le proiezioni ventrolaterali svolgono un ruolo significativamente più importante nella trasmissione delle informazioni nocicettive ascendenti.
Strutture e meccanismi di integrazione del dolore. Una delle principali aree di percezione dell'afflusso afferente e della sua elaborazione è la formazione reticolare del cervello. È qui che finiscono le vie e le collaterali dei sistemi ascendenti e iniziano le proiezioni ascendenti ai nuclei ventro-basale e intralaminare del talamo e successivamente alla corteccia somatosensoriale. Nella formazione reticolare del midollo allungato sono presenti neuroni che vengono attivati esclusivamente da stimoli nocicettivi. Il loro maggior numero (40-60%) è stato trovato nei nuclei reticolari mediali. Sulla base delle informazioni che entrano nella formazione reticolare, si formano i riflessi somatici e viscerali, che sono integrati nelle complesse manifestazioni somatoviscerali della nocicezione. Attraverso le connessioni della formazione reticolare con l'ipotalamo, i gangli della base e il cervello limbico si realizzano le componenti neuroendocrine ed emotivo-affettive del dolore che accompagnano le reazioni di difesa.
Talamo. Esistono 3 principali complessi nucleari che sono direttamente correlati all'integrazione del dolore: il complesso ventro-basale, il gruppo posteriore dei nuclei, i nuclei mediale e intralaminare.
Il complesso ventro-basale è il principale nucleo relè dell'intero sistema afferente somatosensoriale. In sostanza le proiezioni lemniscali ascendenti finiscono qui. Si ritiene che la convergenza multisensoriale sui neuroni del complesso ventro-basale fornisca informazioni somatiche accurate sulla localizzazione del dolore e sulla sua correlazione spaziale. Distruzione
del complesso ventro-basale si manifesta con l'eliminazione transitoria di dolori “rapidi” e ben localizzati e modifica la capacità di riconoscere gli stimoli nocicettivi.
Si ritiene che il gruppo posteriore dei nuclei, insieme al complesso ventro-basale, sia coinvolto nella trasmissione e valutazione delle informazioni sulla localizzazione del dolore e in parte nella formazione delle componenti motivazionale-affettive del dolore.
Le cellule dei nuclei mediale e intralaminare rispondono a stimoli somatici, viscerali, uditivi, visivi e dolorifici. Varie irritazioni nocicettive modali - polpa dentale, A-delta, fibre cutanee C, afferenze viscerali, nonché meccaniche, termiche, ecc., provocano risposte neuronali distinte che aumentano in proporzione all'intensità degli stimoli. Si presume che le cellule dei nuclei intralaminari valutino e decodifichino l'intensità degli stimoli nocicettivi, distinguendoli per durata e modello di scariche.
Corteccia. Tradizionalmente si credeva che la seconda area somatosensoriale fosse di primaria importanza nell’elaborazione delle informazioni sul dolore. Queste idee sono dovute al fatto che la parte anteriore della zona riceve proiezioni dal talamo ventrobasale e la parte posteriore dai gruppi di nuclei mediale, intralaminare e posteriore. Tuttavia, negli ultimi anni, le idee sulla partecipazione di varie aree corticali nella percezione e valutazione del dolore sono state significativamente integrate e riviste.
Lo schema di integrazione corticale del dolore in forma generalizzata può essere ridotto come segue. Il processo di percezione primaria è svolto in misura maggiore dalle aree somatosensoriali e fronto-orbitali della corteccia, mentre altre aree che ricevono estese proiezioni dai vari sistemi ascendenti sono coinvolte nella sua valutazione qualitativa, nella formazione delle risposte motivazionale-affettive e processi psicodinamici che assicurano l'esperienza del dolore e l'attuazione di risposte reazioni al dolore.
Va sottolineato che il dolore, a differenza della nocicezione, non è solo e non tanto una modalità sensoriale, ma anche una sensazione, un'emozione e “uno stato mentale peculiare” (P.K. Anokhin). Pertanto, il dolore come fenomeno psicofisiologico si forma sulla base dell'integrazione dei sistemi nocicettivi e antinocicettivi e dei meccanismi del sistema nervoso centrale.
Sistema antinocicettivo .
Il sistema nocicettivo ha il proprio antipodo funzionale: il sistema antinocicettivo, che controlla l'attività delle strutture del sistema nocicettivo.
Il sistema antinocicettivo è costituito da una varietà di formazioni nervose appartenenti a diverse sezioni e livelli di organizzazione del sistema nervoso centrale, a partire dall'input afferente nel midollo spinale e terminando con la corteccia cerebrale.
Il sistema antinocicettivo svolge un ruolo significativo nei meccanismi di prevenzione ed eliminazione del dolore patologico. Intervenendo nella reazione all'eccessiva stimolazione nocicettiva, indebolisce il flusso della stimolazione nocicettiva e l'intensità della sensazione dolorosa, per cui il dolore rimane sotto controllo e non acquisisce significato patologico. Se l'attività del sistema antinocicettivo viene interrotta, la stimolazione nocicettiva anche di bassa intensità provoca dolore eccessivo.
Il sistema antinocicettivo ha una propria struttura morfologica, meccanismi fisiologici e biochimici. Per il suo normale funzionamento è necessario un afflusso costante di informazioni afferenti, con la sua carenza la funzione del sistema antinocicettivo è indebolita.
Il sistema antinocicettivo è rappresentato da livelli di controllo segmentali e centrali, nonché da meccanismi umorali: sistemi oppioidi, monoaminergici (noradrenalina, dopamina, serotonina), colina-GABAergici.
Diamo un'occhiata brevemente ai meccanismi di cui sopra.
Meccanismi oppiacei di sollievo dal dolore. Per la prima volta nel 1973 fu accertato l'accumulo selettivo di sostanze isolate dall'oppio, come la morfina o i suoi analoghi, in alcune strutture cerebrali. Queste formazioni sono chiamate recettori degli oppiacei. Il maggior numero di essi si trova nelle parti del cervello che trasmettono informazioni nocicettive. È stato dimostrato che i recettori degli oppiacei si legano a sostanze come la morfina o i suoi analoghi sintetici, nonché a sostanze simili prodotte nel corpo stesso. Negli ultimi anni è stata dimostrata l’eterogeneità dei recettori degli oppiacei. Vengono identificati i recettori mu, delta, kappa e sigma degli oppiacei. Ad esempio, gli oppiacei simili alla morfina si legano ai recettori Mu, i peptidi degli oppiacei si legano ai recettori delta.
Oppiacei endogeni. È stato scoperto che nel sangue umano e nel liquido cerebrospinale sono presenti sostanze che hanno la capacità di legarsi ai recettori degli oppiacei. Sono isolati dal cervello degli animali, hanno la struttura degli oligopeptidi e vengono chiamati encefaline(met- e leu-encefalina). Dall'ipotalamo e dall'ipofisi si ottenevano sostanze con peso molecolare ancora maggiore, contenenti molecole di encefalina e chiamate grandi endorfine. Questi composti si formano durante la degradazione della beta-lipotropina e, poiché si tratta di un ormone ipofisario, è possibile spiegare l'origine ormonale degli oppioidi endogeni. Sostanze con proprietà oppiacei e una diversa struttura chimica sono ottenute da altri tessuti: si tratta di leu-beta-endorfina, citorfina, dinorfina, ecc.
Diverse aree del sistema nervoso centrale hanno una sensibilità diversa alle endorfine e alle encefaline. Ad esempio, la ghiandola pituitaria è 40 volte più sensibile alle endorfine che alle encefaline. I recettori degli oppiacei si legano in modo reversibile agli analgesici narcotici e questi ultimi possono essere spiazzati dai loro antagonisti, ripristinando la sensibilità al dolore.
Qual è il meccanismo dell'effetto analgesico degli oppiacei? Si ritiene che si connettano ai recettori (nocicettori) e, poiché sono grandi, impediscono al neurotrasmettitore (sostanza P) di connettersi ad essi. È anche noto che gli oppiacei endogeni hanno anche un effetto presinaptico. Di conseguenza, il rilascio di dopamina, acetilcolina, sostanza P e prostaglandine diminuisce. Si presume che gli oppiacei causino l'inibizione della funzione dell'adenilato ciclasi nella cellula, una diminuzione della formazione di cAMP e, di conseguenza, l'inibizione del rilascio di mediatori nella fessura sinaptica.
Meccanismi adrenergici di sollievo dal dolore. È stato stabilito che la norepinefrina inibisce la conduzione degli impulsi nocicettivi sia a livello segmentale (midollo spinale) che a livello del tronco encefalico. Questo effetto si realizza attraverso l'interazione con i recettori alfa adrenergici. Quando esposto al dolore (così come allo stress), il sistema simpatico-surrenale (SAS) viene bruscamente attivato, gli ormoni trofici, la beta-lipotropina e la beta-endorfina vengono mobilitati come potenti polipeptidi analgesici della ghiandola pituitaria, le encefaline. Una volta nel liquido cerebrospinale, colpiscono i neuroni del talamo, la materia grigia centrale del cervello e le corna posteriori del midollo spinale, inibendo la formazione della sostanza P, mediatrice del dolore, e fornendo così un'analgesia profonda. Allo stesso tempo, aumenta la formazione di serotonina nel nucleo maggiore del rafe, che inibisce anche l'attuazione degli effetti della sostanza P. Si ritiene che durante l'agopuntura vengano attivati gli stessi meccanismi di sollievo dal dolore
stimolazione delle fibre nervose non dolorose.
Per illustrare la diversità dei componenti del sistema antinocicettivo, va detto che sono stati identificati molti prodotti ormonali che hanno un effetto analgesico senza attivare il sistema oppioide. Questi sono vasopressina, angiotensina, ossitocina, somatostatina, neurotensina. Inoltre, il loro effetto analgesico può essere molte volte più forte di quello delle encefaline.
Esistono altri meccanismi di sollievo dal dolore. È stato dimostrato che l'attivazione del sistema colinergico rafforza e il suo blocco indebolisce il sistema della morfina. Si ritiene che il legame dell'acetilcolina ad alcuni recettori M centrali stimoli il rilascio di peptidi oppioidi. L'acido gamma-aminobutirrico regola la sensibilità al dolore, sopprimendo le reazioni emotive e comportamentali al dolore. Il dolore, attivando la trasmissione GABA e GABAergica, garantisce l'adattamento dell'organismo allo stress doloroso.
Dolore acuto. Nella letteratura moderna si possono trovare diverse teorie che spiegano l'origine del dolore. Il più diffuso è il cosiddetto Teoria del "cancello" di R. Melzack e P. Wall. Sta nel fatto che la sostanza gelatinosa del corno dorsale, che fornisce il controllo degli impulsi afferenti che entrano nel midollo spinale, agisce come una porta che fa passare gli impulsi nocicettivi verso l'alto. Inoltre, un ruolo importante giocano le cellule T della sostanza gelatinosa, dove avviene l'inibizione presinaptica dei terminali; in queste condizioni, gli impulsi dolorifici non passano oltre al centro
strutture cerebrali e il dolore non si verificano. Secondo concetti moderni, la chiusura del "cancello" è associata alla formazione di encefaline, che inibiscono l'attuazione degli effetti del più importante mediatore del dolore: la sostanza P. Se l'afflusso di afferentazione lungo A-delta e C -fibre aumentano, le cellule T vengono attivate e le cellule della sostanza gelatinosa vengono inibite, il che rimuove l'effetto inibitorio dei neuroni gelatinosi della sostanza sui terminali afferenti delle cellule T. Pertanto, l'attività delle cellule T supera la soglia di eccitazione e il dolore si verifica a causa della facilitazione della trasmissione degli impulsi dolorifici al cervello. In questo caso si apre il “cancello d’ingresso” per le informazioni sul dolore.
Un punto importante di questa teoria è tenere conto degli influssi centrali sul “gate control” nel midollo spinale, perché processi come l’esperienza di vita e l’attenzione influenzano la formazione del dolore. Il sistema nervoso centrale controlla gli input sensoriali attraverso influenze reticolari e piramidali sul sistema portale. Ad esempio, R. Melzack fornisce il seguente esempio: una donna scopre improvvisamente un nodulo al seno e, preoccupandosi che si tratti di cancro, può improvvisamente sentire dolore al petto. Il dolore può intensificarsi e persino diffondersi alla spalla e al braccio. Se il medico riesce a convincerla che il nodulo non è pericoloso, il dolore potrebbe scomparire immediatamente.
La formazione del dolore è necessariamente accompagnata dall'attivazione del sistema antinocicettivo. Cosa influenza la riduzione o la scomparsa del dolore? Si tratta innanzitutto di informazioni che arrivano attraverso le fibre spesse e a livello delle corna dorsali del midollo spinale, favorendo la formazione delle encefaline (del loro ruolo abbiamo parlato sopra). A livello del tronco encefalico si attiva il sistema analgesico discendente (nuclei dello stupro) che, attraverso meccanismi serotoninergici, noradrenalina ed encefalinergici, esercita influenze discendenti sulle corna dorsali e quindi sull'informazione dolorifica. A causa dell'eccitazione del SAS viene inibita anche la trasmissione dell'informazione dolorosa e questo è il fattore più importante per favorire la formazione di oppiacei endogeni. Infine, grazie alla stimolazione dell'ipotalamo e dell'ipofisi, viene attivata la formazione di encefaline ed endorfine e viene rafforzata l'influenza diretta dei neuroni ipotalamici sulle corna dorsali del midollo spinale.
Dolore cronico.Con danni tissutali a lungo termine (infiammazione, fratture, tumori, ecc.), La formazione del dolore avviene allo stesso modo del dolore acuto, solo informazioni costanti sul dolore, causando una forte attivazione dell'ipotalamo e della ghiandola pituitaria, SAS, formazioni limbiche del cervello, è accompagnato da cambiamenti più complessi ea lungo termine nella psiche, nel comportamento, nelle manifestazioni emotive, nell'atteggiamento verso il mondo esterno (allontanamento dal dolore).
Secondo la teoria di G.N. Il dolore cronico di Kryzhanovsky si verifica a seguito della soppressione dei meccanismi inibitori, soprattutto a livello delle corna dorsali del midollo spinale e del talamo. Allo stesso tempo, nel cervello si forma un generatore di eccitazione. Sotto l'influenza di fattori esogeni ed endogeni in alcune strutture del sistema nervoso centrale, a causa dell'insufficienza dei meccanismi inibitori, sorgono generatori di eccitazione patologicamente potenziata (PAE), che attivano connessioni positive, causando l'epilessia dei neuroni di un gruppo e aumentando l'eccitabilità di altri neuroni.
Dolore fantasma(dolore agli arti amputati) si spiegano principalmente con una carenza di informazioni afferenti e, di conseguenza, viene eliminato l'effetto inibitorio delle cellule T a livello delle corna del midollo spinale e qualsiasi afferenza dalla regione delle corna posteriori viene percepita come dolorosa .
Dolore riferito. La sua comparsa è dovuta al fatto che le afferenze degli organi interni e della pelle sono collegate agli stessi neuroni del corno dorsale del midollo spinale, che danno origine al tratto spinotalamico. Pertanto, l'afferenza proveniente dagli organi interni (se danneggiati) aumenta l'eccitabilità del dermatomero corrispondente, che viene percepito come dolore in questa zona della pelle.
Le principali differenze tra le manifestazioni del dolore acuto e cronico.
1. Nel dolore cronico, le reazioni riflesse autonomiche diminuiscono gradualmente fino a scomparire e prevalgono i disturbi autonomici.
2. Nel dolore cronico di norma non si verifica un sollievo spontaneo del dolore, per attenuarlo è necessario l'intervento del medico.
3. Se il dolore acuto svolge una funzione protettiva, il dolore cronico provoca disturbi più complessi e a lungo termine nel corpo e porta (J. Bonica, 1985) a un progressivo "logorio" causato da disturbi del sonno e dell'appetito, diminuzione dell'attività fisica e trattamenti spesso eccessivi.
4. Oltre alla paura caratteristica del dolore acuto e cronico, quest'ultimo è caratterizzato anche da depressione, ipocondria, disperazione, disperazione e ritiro dei pazienti da attività socialmente utili (anche idee suicide).
Disfunzioni del corpo durante il dolore. Disturbi funzionali N.S. con dolore intenso, si manifestano come disturbi del sonno, della concentrazione, del desiderio sessuale e aumento dell'irritabilità. Con il dolore cronico intenso, l'attività motoria di una persona diminuisce drasticamente. Il paziente è in uno stato di depressione, la sensibilità al dolore aumenta a causa della diminuzione della soglia del dolore.
Un dolore leggero accelera la respirazione, ma uno molto forte rallenta la respirazione finché non si ferma. La frequenza cardiaca e la pressione arteriosa sistemica possono aumentare e si può sviluppare spasmo vascolare periferico. La pelle diventa pallida e, se il dolore è di breve durata, lo spasmo vascolare è sostituito dalla loro dilatazione, che si manifesta con arrossamento della pelle. La funzione secretoria e motoria del tratto gastrointestinale cambia. A causa della stimolazione del SAS, viene prima rilasciata la saliva densa (in generale, la salivazione aumenta) e poi, a causa dell'attivazione della parte parasimpatica del sistema nervoso, diventa liquida. Successivamente, la secrezione di saliva, succo gastrico e pancreatico diminuisce, la motilità dello stomaco e dell'intestino rallenta e sono possibili oligo- e anuria riflessa. Con un dolore molto acuto, c'è la minaccia di shock.
I cambiamenti biochimici si manifestano sotto forma di aumento del consumo di ossigeno, degradazione del glicogeno, iperglicemia, iperlipidemia.
Il dolore cronico è accompagnato da forti reazioni autonomiche. Ad esempio, cardialgia e mal di testa sono associati ad aumento della pressione sanguigna, temperatura corporea, tachicardia, dispepsia, poliuria, aumento della sudorazione, tremore, sete e vertigini.
Una componente costante della risposta al dolore è l’ipercoagulazione del sangue. È stato dimostrato un aumento della coagulazione del sangue nei pazienti al culmine di un attacco di dolore, durante gli interventi chirurgici e nel primo periodo postoperatorio. Nel meccanismo dell'ipercoagulazione durante il dolore, l'accelerazione della trombinogenesi è di primaria importanza. Sapete che il meccanismo esterno di attivazione della coagulazione del sangue viene avviato dalla tromboplastina tissutale e, durante il dolore (stress), la tromboplastina viene rilasciata dalla parete vascolare intatta. Inoltre, con il dolore, diminuisce il contenuto degli inibitori fisiologici della coagulazione nel sangue: antitrombina, eparina. Un altro cambiamento caratteristico del dolore nel sistema emostatico è la trombocitosi da ridistribuzione (l'ingresso di piastrine mature nel sangue dal deposito polmonare).