Malattie ereditarie del metabolismo lipidico. Enzimopatie Forme ereditarie di disturbi del metabolismo lipidico
I disturbi ereditari e acquisiti del metabolismo lipidico sono i disturbi metabolici più comuni nella popolazione dei paesi sviluppati dal punto di vista medico. Secondo l'OMS, il 10% della popolazione mondiale soffre di una sorta di dislipoproteinemia.
Il 50% delle donne e il 20% degli uomini sono obesi. La metà del tasso di mortalità è dovuta a malattie cardiovascolari, mentre la patogenesi della malattia coronarica e dell'ictus dovuto all'ipertensione è l'aterosclerosi vascolare. L'aterosclerosi è un processo a lungo termine e pluriennale. Il debutto dell'aterosclerosi risale all'inizio della 2a decade di vita. Pertanto è materia per pediatri, internisti e geriatri.
I lipidi sono un ampio gruppo di composti organici.
Caratteristica:
Insolubilità in acqua
Solubilità in etere, benzene, acetone,
La presenza di radicali assilici superiori nella molecola.
I lipidi semplici contengono C, H, O2. L'idrolisi produce acidi grassi e alcoli.
I lipidi complessi contengono inoltre azoto, fosforo e zolfo.
Esempi di lipidi semplici sono acidi grassi, gliceridi-triacilgliceridi, colesterolo, retinolo, calceferolo.
Lipidi complessi - fosfolipidi (glicerolipidi, sfingolipidi) e glicolipidi (gangliosidi, cerebrosidi).
Funzioni dei lipidi:
La funzione di riserva energetica è fornita dai trigliceridi,
Formatori di membrana: glicerofosfolipidi,
Mediatore del recettore - associato al metabolismo dei glicerofosfolipidi,
Segnalazione regolatoria - associata agli alcoli lipidici - con steroidi.
Il grasso è la principale risorsa energetica del corpo. Il glicogeno viene rapidamente mobilitato e ne sono presenti diverse decine di grammi e il 23% di grasso nel corpo. .
2 kg di grasso sono grassi costituzionali sotto forma di inclusioni, il resto è negli adipociti. La metà si trova nel grasso sottocutaneo e l'altra metà nel compartimento vescerale del corpo e nell'omento. Abbastanza per soddisfare il fabbisogno energetico del corpo per 40 giorni. -70-90t kcal. Il miocardio utilizza gli acidi grassi per il fabbisogno energetico. L'accumulo di grasso neutro svolge anche una funzione di risparmio di calore, di isolamento elettrico e meccanica.
Nei neonati, il tessuto adiposo si sviluppa nell'ultimo mese e mezzo, quindi i bambini prematuri nascono senza accumulo di tessuto adiposo, necessitano di alimentazione frequente, sono soggetti a lesioni meccaniche e necessitano di riscaldamento nelle incubatrici. L'accumulo di grassi neutri nell'omento, nel tessuto sottocutaneo e negli adipociti è chiamato obesità. Trasformazione del grasso-
Questo è l’accumulo di grassi al di fuori degli adipociti nel fegato, nel miocardio e nei reni.
I fosfolipidi fanno parte delle membrane cellulari.Ci sono molti sfingosidi nel tessuto nervoso e nella mielina. La membrana metocondriale è ricca di cardiolipina, che ha proprietà antigeniche. Gli autoanticorpi contro la cardiolipina si trovano in malattie immunopatologiche come il lupus eritematoso. La cardiolipina è un lipide della cromatina che interagisce con il DNA e influenza l'espressione genica. Le membrane contengono colesterolo, che è uno stabilizzatore delle membrane. Lo strato esterno della membrana contiene fosfoditilcolina.La perdita di sfingolipidi si osserva quando iniziano la coagulazione, l'aggregazione e la DIC. (tromboplastina tissutale) Grazie alla membrana avviene la compartimentazione cellulare.
Quelli. la sua suddivisione in compartimenti. Il veleno di serpenti e ragni, vespe, contiene fosfolipasi, che distrugge le membrane cellulari. I fosfolipidi di membrana devono essere costantemente rinnovati. Ciò accade a causa di LDL, VLDL.
Con qualsiasi alterazione della membrana cellulare si formano BAS-ecosanoidi.
Il ruolo di mediazione dei recettori consente ai lipidi di partecipare al riconoscimento dei segnali chimici e alla loro consegna agli effettori intracellulari. Questa funzione è eseguita da lipidi complessi: cerebrosidi, gangliosidi. Qualsiasi recettore cellulare contiene una parte proteica e un ganglioside, che sono coinvolti nelle proprietà immunologiche delle membrane. Esiste un'intera classe di malattie ereditarie dei gangliosidi, quando il metabolismo di vari lipidi complessi viene interrotto a causa di un difetto negli enzimi lisosomiali. Il ruolo dei trasduttori del segnale 11 mediatori della proteina chinasi, fosfolipasi insieme alla proteina G
Digestione e assorbimento alterati delle proteine.
La digestione dei lipidi avviene nell'intestino tenue. Nei bambini, la lipasi viene prodotta nello stomaco (e sulla base della lingua e nella parte posteriore della gola). Ciò è facilitato dal basso pH dello stomaco -5.
Negli adulti, l’enzima principale che scompone i grassi è la lipasi pancreatica, che a un pH di 8-9 nell’intestino tenue e nel duodeno scompone gli acidi biliari e il β-monoglicerile, ma non la licirina. La lipasi agisce sulla superficie delle goccioline di grasso emulsionate. Pertanto, la sua attività dipende dalla presenza di emulsionanti contenenti bile. Gli acidi biliari sono glicocolico, taurocolico, glicochenodesossicolico e taurochenodesossicolico. Lo sciogliemento del bolo alimentare è facilitato dall'anidride carbonica che si forma quando l'acido gastrico viene neutralizzato dai bicarbonati intestinali. Gli acidi biliari sulla superficie degli acidi grassi e dei monogliceridi formano sali sulla superficie delle goccioline di grasso e impediscono loro di coalizzarsi. La superficie disponibile per la lipasi aumenta. La fosfolipasi pancreatica scompone i fosfolipidi, producendo acidi grassi e lisofosfolipidi, che agiscono anche come emulsionante. Successivamente si forma la glicerinfofocolina, che si dissolve in acqua e acidi grassi, che vengono assorbiti nel sangue. Gli esteri del colesterolo vengono scomposti dalla colesterolo esterasi nel pancreas e succhi intestinali. Piccole particelle emulsionate vengono assorbite nel sangue senza previa idrolisi. Quelli più grandi subiscono idrolisi e vengono assorbiti con l'aiuto degli acidi biliari. Le micelle sono formate da fosfolipidi, CN, acidi biliari, nonché acidi grassi e monogliceridi provenienti dal cibo. Assorbono inoltre le vitamine liposolubili CN e vengono assorbiti senza dispendio energetico e mediante pinocitosi negli enterociti. Negli enterociti gli acidi biliari vengono scissi, assorbiti nel sangue e inviati al fegato: si tratta del ricircolo enteroepatico. Fino a 8 cicli al giorno. Il circuito enteroepatico svolge un ruolo sia nella regolazione del metabolismo del CN che nel funzionamento ottimale degli epatociti. Gli acidi biliari migliorano l'afflusso di sangue al fegato, stimolano osmoticamente la formazione della bile e migliorano la motilità intestinale. La colestasi porta non solo a problemi di digestione e assorbimento dei lipidi, ma anche a cambiamenti nel trasporto del colesterolo, che porta all'ipercolesterolemia.
La risintesi dei lipidi avviene negli enterociti. Fosfolipidi e grassi neutri con una struttura caratteristica dell'uomo sono formati da monogliceridi e acidi grassi. La capacità di trasformare i lipidi nella parete intestinale è limitata. Pertanto, con un apporto eccessivo, una parte dei grassi oltrepassa la barriera intestinale e si deposita negli adipociti. Nel reticolo endoplasmatico degli enterociti si formano grandi complessi lipoproteici - chilomicroni. Contengono trigliceridi, fosfolipidi e colesterolo. La superficie del CM è ricoperta dalla proteina idrofila apoproteina B, che viene sintetizzata negli enterociti. Il chilomicrone finito entra nella linfa attraverso i vasi mammari, attraverso il dotto linfatico toracico nel cuore destro. Ciò conferisce al plasma sanguigno un colore lattiginoso dopo la saturazione.
Tutti questi processi vengono interrotti quando:
A causa della mancanza di bile nell'intestino (acolia), bassa acidità del succo gastrico,
A causa di una violazione del flusso del succo pancreatico nell'intestino,
A causa di malassorbimento primario (sprue, ipovitaminosi,
Quando si assumono grassi refrattari (grasso di agnello,
Con la peristalsi intestinale accelerata, sotto l'azione di antibiotici, ipoeorticismo e con un eccesso di cationi alcalino-terrosi nel cibo e nell'acqua, si possono formare sali di calcio-magnesio degli acidi grassi. La ritenzione di lipidi nell'intestino può verificarsi con l'aiuto di resine a scambio ionico, si formano colesterolo, questrolo, colestinoolo. In tutti i casi di alterato assorbimento e digestione dei lipidi, appare la steatorrea: feci frequenti, appiccicose, di colore chiaro con grumi di grasso In caso di steatorrea cronica si sviluppa ipovitaminosi delle vitamine liposolubili. Con l'acolia, le feci sono scolorite.
Trasporto dei lipidi nel corpo.
Il contenuto di lipidi nel corpo è di 4-8 g/l. Nel sangue i lipidi formano complessi con l’albumina. Questi sistemi di trasporto consegnano i grassi al sito di smaltimento. I restanti lipidi formano complessi con proteine e apoproteine e si formano le lipoproteine. Le particelle lipoproteiche trasportano i lipidi tra i luoghi del loro assorbimento o formazione, utilizzo e stoccaggio. L trasportano anche ormoni liposolubili e vitamine. . LP ha un guscio idrofilo e un nucleo idrofobo. Il guscio contiene fosfolipidi, apoproteine e colesterolo, che ne garantiscono la solubilità e determinano le vie metaboliche. Il nucleo idrofobico contiene esteri di holdesterolo e trigliceridi. Esistono 5 classi di farmaci. La loro principale differenza è nella composizione dell'apoproteina. Alcuni di essi sono ricchi di TG, altri di colesterolo e altri di fosfolipidi. I principali trigliceridi vengono trasportati come parte del CM e delle lipoproteine a densità molto bassa. Il CN è presente più abbondantemente nelle LDLP e nelle LDL. L'HDL è ricco di fosfolipidi. Gli EC sono significativamente contenuti nelle LDL e nelle HDL
VLDL, LPPP e LDL vengono convertiti indirettamente l'uno nell'altro. CM e HDL trasportano i lipidi in altri siti della loro circolazione, principalmente nel fegato o per diffusione laterale da una particella all'altra. La circolazione dei farmaci nel vortanismo è caratterizzata da quanto segue. Caratteristiche. CM appare nella lipemia da assorbimento, si forma negli enterociti, apoproteine CM. Sono A e C di origine epatica e intestinale. HM, passando attraverso il lato destro del cuore nel flusso sanguigno, perde costantemente trigliceridi e l'ex anello idrofobico perde gradualmente peso. Ciò si verifica a causa della lipolisi delle lipoproteine. Le particelle residue sono fosfolipidi, CN e apoproteine, da cui si formano poi le HDL. Il plasma diventa limpido (dopo 14 ore dall'assunzione di cibo). E il CM viene completamente rimosso con l'aiuto dell'enzima lipoproteina lipasi. Questo enzima è prodotto dalla parete capillare in risposta al carico di grasso. La maggiore attività lipolitica è esibita dai capillari del tessuto adiposo di muscoli, polmoni e cuore. Nei polmoni avviene il processo di catabolismo parziale dei CM, necessario per la sintesi dei fosfolipidi tensioattivi.
L'attività della lipoproteina lipasi (LPL) è stimolata dall'insulina e dall'ormone della crescita. L'eparina non è un cofattore dell'LPL, ma ne innesca la secrezione. Il plasma diventa più luminoso. L'albumina TK è coinvolta nel trasporto dei lipidi durante l'ipoalbuminemia; il ritardo nel catabolismo dei CM e di altri farmaci e l'iperlipoproteinemia e LPL influenzano anche la trombofelia delle VLDL. L'albumina lega i NEFA
Ad alte concentrazioni e modifiche, il farmaco può essere esposto all'azione dei fagociti, dei macrofagi, soprattutto in condizioni di attività delle citochine durante l'infiammazione, e può anche entrare negli immunocomplessi e tutto questo viene catturato dai macrofagi, dai fagociti e si forma xantoma o xantomatosi . Gli xantomi possono formarsi in qualsiasi tessuto, compresa la dura madre e le ossa del cranio, e si formano difetti di colore giallo-arancione.
Iperlipoproteinemia e dislipoproteinemia.
La particolarità è che possono essere asintomatici e manifestarsi come pancreatite o aterosclerosi potenzialmente letale.
Il livello delle lipoproteine nel sangue dipende dall'azione congiunta di diversi geni. Molti fattori ambientali influenzano anche il livello dei lipidi. Questo è caratterizzato da eredità multifattoriale.
Parametri lipidici nel sangue
Colesterolo nel sangue 5,2 -6 mmol/l, superiore a 6 – patologia, (200 mg/dl)
Il livello dei trigliceridi totali è 1,6 mmol\l (140 mg), il limite accettabile è 2,2-2,8 più alto - ipertrigliceridemia - alto rischio di sviluppare aterosclerosi e disturbi della pressione arteriosa,
LDL-1,3-4,3 g/l 140-4300 mg/dl.
La diminuzione dell'HDL-interaterogenico-1,3-4,3 nell'HDL aumenta il rischio di sviluppare aterosclerosi.
L'iperlipedemia primaria di tipo 1 della malattia di Bürger-Grütz è una malattia ereditaria autosomica recessiva, con un difetto di LPL.I ChM si accumulano nel sangue e, a causa del blocco del loro catabolismo, provocano trombosi e micronecrosi ischemica, soprattutto a livello del pancreas.
PGLP tipo 5 - assenza di apoproteina C, mentre si accumulano LPL, CM e VLDL
La PGLD di tipo 2a si sviluppa con la malattia fatale dell'ipercolesterolemia ereditaria: sono presenti molti xantomi nella zona del tendine di Achille, negli occhi, nelle cosce, nei gomiti, negli stinchi nelle pieghe interdigitali, ecc. Morire di infarto in tenera età
Abetolipoprteinemia, bassi livelli di apoproteina B, ecc.
L'aterosclerosi è una malattia progressiva delle grandi e dannose arterie elastiche e muscolo-elastiche, ma non delle arteriole, caratterizzata da una risposta proliferativa-sintetica di un numero di cellule della parete vascolare e del sangue, cellule muscolari lisce di macrofagi, piastrine, fibroblasti, a lipoproteine patologiche (qualitativamente originali o quantitativamente eccessive) lipoproteine con formazione di ateromi e placche (fibrino-lipidiche) nell'intima. La progressione degli ateromi porta al coinvolgimento della parete vascolare con ulcerazione, calcificazione, trombosi, vasocostrizione, spasmo arterioso, disturbi della microcircolazione, formazione di coaguli di sangue, ictus e attacchi cardiaci, trombosi dei vasi mesenterici, aterosclerosi delle arterie renali e vasi delle estremità.
Malattia di Niemann-Pick di tipo A e B - diminuzione dell'attività dell'enzima sfingomielinasi dell'acido lisosomiale, codificato dal gene SMPD1 (HSA11p15.4-p15.1). Tipo di eredità
niya: autosomico recessivo.
La violazione del metabolismo dei lipidi porta all'accumulo di lipidi nel fegato, nei polmoni, nella milza e nei tessuti nervosi. Caratterizzato da degenerazione delle cellule nervose, interruzione del sistema nervoso, aumento dei livelli di colesterolo e lipidi nel sangue. Il tipo A è letale nella prima infanzia. Il tipo B è più lieve; i pazienti, di regola, sopravvivono fino all'età adulta. Diversi tipi sono causati da diverse mutazioni nel gene SMPD1.
La malattia di Gaucher (lipidosi da glicosilceramide) è l'accumulo di glucocerebrosidi nelle cellule del sistema nervoso e reticoloendoteliale, causato da un deficit dell'enzima glucocerebrosidasi, codificato dal gene GBA (HSA1q21). Appartiene al gruppo delle malattie da accumulo lisosomiale. Alcune forme della malattia si manifestano con gravi danni al fegato, alla milza, al tessuto nervoso e alle ossa.
Malattie ereditarie del metabolismo delle purine e delle pirimidine
La sindrome di Lesch-Nychen è una malattia recessiva legata al sesso in cui il contenuto di acido urico in tutti i fluidi corporei aumenta notevolmente. La conseguenza di ciò è un ritardo dello sviluppo, un moderato ritardo mentale, attacchi di comportamento aggressivo con autolesionismo. Alla base di questa malattia c'è l'insufficienza dell'attività enzimatica dell'ipoxantina-guanina fosforibosiltransferasi dovuta a mutazioni nel gene HP^1 (HSAXq26-q27.2). Sono state descritte diverse mutazioni nello stesso gene, la cui conseguenza è la gotta (alterazione del metabolismo delle purine e deposito di composti di acido urico nei tessuti).
Disturbi metabolici del tessuto connettivo
La sindrome di Marfan (“dita di ragno”, aracnodattilia) è una lesione del tessuto connettivo dovuta a una mutazione nel gene FBN1 (HSA15q21.1), responsabile della sintesi della fibrillina. Ereditato con modalità autosomica dominante. Il polimorfismo clinico della malattia è spiegato da un gran numero di alleli mutanti, ognuno dei quali può manifestarsi
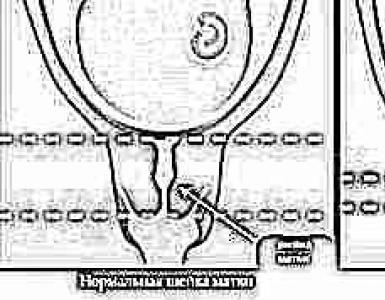
stato eterozigote. I pazienti sono caratterizzati da alta statura, fisico astenico (arti sproporzionatamente lunghi), aracnodattilia (dita lunghe e sottili), debolezza dell'apparato legamentoso, distacco della retina, sublussazione del cristallino, prolasso della valvola mitrale (Fig. 99).
Riso. 99. Sindrome di Marfan |
Le mucopolisaccaridosi sono un gruppo di malattie del tessuto connettivo associate ad un alterato metabolismo dei glicosaminoglicani acidi (mucopolisaccaridi) causato da una carenza di alcuni enzimi lisosomiali. Queste malattie sono classificate come malattie da accumulo lisosomiale. Si manifestano in vari difetti delle ossa e del tessuto connettivo. La mucopolisaridosi di tipo I (sindrome di Hurler) è una malattia autosomica recessiva derivante dal deficit dell'enzima alfa-iduronidasi dovuto a mutazioni nel gene JIA (HSA4q16.3). Ciò porta all'accumulo di complessi proteine-carboidrati e grassi nelle cellule del corpo. Di conseguenza, i pazienti presentano bassa statura, ritardo mentale significativo, ingrossamento del fegato e della milza, difetti cardiaci, annebbiamento della cornea, deformazione ossea e ingrossamento dei tratti del viso (Fig.
100).
La mucopolisaccaridosi di tipo II (sindrome di Hunter) è una malattia recessiva legata al sesso causata da un difetto nell'enzima iduronato sulfotasi dovuto a una mutazione nel gene IDS (HSAXq28). Le sostanze di accumulo sono dermatan ed eparan solfati. Caratterizzato da tratti del viso ruvidi, scafocefalia, respiro rumoroso, voce bassa e ruvida, frequenti infezioni virali respiratorie acute (Fig. 101). All'età di 3-4 anni compaiono disturbi nella coordinazione dei movimenti: l'andatura diventa goffa, i bambini spesso cadono mentre camminano. I pazienti sono caratterizzati da labilità emotiva e aggressività.
Si osservano anche perdita progressiva dell'udito, lesioni cutanee nodulari della schiena, artrosi e lesioni corneali.
 Riso. 101. Sindrome di Hunter* |
La mucopolisaccaridosi di tipo III (sindrome di Sanfilippo, malattia di Sanfilippo) è una malattia causata dall'accumulo di eparan solfato. È caratterizzata da eterogeneità genetica: esistono quattro tipi di questa malattia, causati da mutazioni in quattro diversi geni che codificano per enzimi coinvolti nel metabolismo delle sostanze accumulate. I primi sintomi della malattia sotto forma di disturbi del sonno compaiono nei bambini di età superiore ai tre anni. L'apatia si sviluppa gradualmente, c'è un ritardo nello sviluppo psicomotorio, disturbi del linguaggio e le caratteristiche facciali diventano grossolane. Col passare del tempo, i bambini smettono di riconoscere gli altri. I pazienti sono caratterizzati da ritardo della crescita, contratture articolari, ipertricosi ed epatosplenomegalia moderata. A differenza delle sindromi di Hurler e Hunter, nella malattia di Sanfilippo predomina il ritardo mentale e non sono presenti lesioni della cornea e del sistema cardiovascolare.
La fibrodisplasia (miosite ossificante, ossificazione eterotopica paraossea, malattia di Munheimer) è una malattia del tessuto connettivo associata alla sua ossificazione progressiva a causa di una mutazione nel gene ACVR1 (HSA2q23-q24), che codifica per il recettore dell'attivina A. Il tipo di eredità è autosomico dominante. La malattia si manifesta con difetti congeniti dello sviluppo - principalmente alluci ricurvi e disturbi nella colonna cervicale a livello delle vertebre c2 - c7. La malattia ha un carattere progressivo e porta a notevoli alterazioni dello stato funzionale del sistema muscolo-scheletrico, profonda disabilità dei pazienti e morte, soprattutto nell'infanzia e nella giovane età (Fig. 103). La malattia è anche chiamata “malattia del secondo scheletro”, poiché dove dovrebbero verificarsi i normali processi antinfiammatori nel corpo, inizia la crescita ossea.
Disturbi delle proteine circolanti
Le emoglobinopatie sono disturbi ereditari della sintesi dell'emoglobina. Esistono due gruppi di emoglobinopatie. Il primo è caratterizzato da un cambiamento nella struttura primaria della proteina globina, che può essere accompagnato da disturbi nella sua stabilità e funzione (ad esempio, anemia falciforme). Nelle emoglobinopatie del secondo gruppo, la struttura dell'emoglobina rimane normale, solo la velocità di sintesi delle catene globiniche è ridotta (ad esempio (5-talassemia).
Disturbi metabolici nei globuli rossi
La sferocitosi ereditaria è una carenza congenita di lipidi nella membrana degli eritrociti. La malattia è caratterizzata da una modalità di trasmissione autosomica dominante o autosomica recessiva, a seconda della mutazione del gene ERTA1 (HSA1q21), che codifica la spettrina α-1 eritrocitaria. Un'anomalia di questa proteina porta ad un aumento della concentrazione di ioni sodio all'interno dell'eritrocito e alla penetrazione di acqua in eccesso al suo interno a causa di un aumento della pressione osmotica. Di conseguenza, si formano globuli rossi sferici: sferociti che, a differenza dei normali globuli rossi biconcavi, non hanno la capacità di cambiare forma in aree ristrette del flusso sanguigno, ad esempio quando passano nei seni della milza. Ciò porta ad un rallentamento del movimento degli eritrociti nei seni della milza e al distacco di parte della membrana eritrocitaria con formazione di microsferociti. I globuli rossi distrutti vengono assorbiti dai macrofagi della milza. L'emolisi dei globuli rossi porta all'iperplasia delle cellule della polpa e all'ingrossamento della milza. Uno dei principali sintomi clinici è l'ittero. I principali sintomi della sferocitosi ereditaria sono l'ingrossamento della milza (di solito sporgente da sotto l'ipocondrio di 2-3 cm) e l'ittero. A volte si notano segni di sviluppo ritardato, disturbi dello scheletro facciale, cranio a torre, naso a sella, palato alto, irregolarità nella posizione dei denti e orbite strette.
Malattie ereditarie del metabolismo dei metalli
La malattia di Konovalov-Wilson (distrofia epatocerebrale) è una malattia autosomica recessiva del metabolismo del rame, che causa gravi danni al sistema nervoso centrale e agli organi interni. La malattia è causata dalla sintesi bassa o anormale di ceruloplasmina (proteina di trasporto del rame) a causa dell'attività enzimatica insufficiente dell'ATPasi che trasporta il rame. Le mutazioni (ne sono state descritte circa 200) nel gene ATP7B (HSA13q14-q21) portano a cambiamenti nel polipeptide p di questo enzima, che è la base genetica di questa patologia. Il ruolo principale nella patogenesi è giocato da una violazione del metabolismo del rame, dal suo accumulo nei tessuti nervoso, renale, epatico e corneale, con conseguente danno tossico a questi organi da parte del rame. Nel fegato si forma una cirrosi nodulare grande o mista. Nei reni, sono colpiti principalmente i tubuli prossimali. Nel cervello, i gangli della base, il nucleo dentato del cervelletto e la substantia nigra sono i più colpiti.
Malassorbimento nel tratto digestivo
La fibrosi cistica (fibrosi cistica) è una malattia autosomica recessiva caratterizzata da danni alle ghiandole esocrine e grave disfunzione del tratto respiratorio e gastrointestinale. La causa sono le mutazioni del gene CFTR (HSA7q31.2), che codifica per un regolatore transmembrana della fibrosi cistica. La malattia è caratterizzata da danni alle ghiandole esocrine, grave disfunzione del sistema respiratorio e del tratto gastrointestinale.
L'intolleranza al lattosio (ipolactasia) è una condizione patologica autosomica recessiva caratterizzata da scarso assorbimento del lattosio (zucchero del latte), la cui base genetica sono le mutazioni nelle regioni regolatrici e codificanti del gene LCT (HSA2q21), che codifica per la lattasi. Questo enzima è espresso prevalentemente nelle cellule ciliate dell'intestino ed è responsabile della scomposizione del lattosio in galattosio e glucosio. I principali sintomi della carenza di lattasi sono flatulenza, dolore addominale, diarrea e vomito. Nei bambini, la carenza di lattasi può manifestarsi come stitichezza cronica, irrequietezza e pianto dopo aver mangiato. In diverse popolazioni umane, le frequenze degli alleli mutanti variano dall'1 al 100%.
Disturbi ormonali
La femminilizzazione testicolare (sindrome di Morris) è una malattia recessiva legata al sesso quando un fenotipo femminile appare con un cariotipo maschile (46, XY). L'espressività varia. Con la femminilizzazione incompleta, le gonadi si sviluppano secondo il tipo maschile, ma alcuni caratteri sessuali corrispondono al sesso femminile con vari gradi di gravità: clitoride ipertrofico, chiusura incompleta della sutura scrotale, grandi labbra a forma di scroto, vagina accorciata (Fig. 104). Con la femminilizzazione completa, il sintomo principale è l'assenza di mestruazioni e crescita dei peli sessuali con ghiandole mammarie ben sviluppate e un fenotipo femminile. La malattia è causata da varie mutazioni nel gene AR (HSAXq11-q12), che codifica per il recettore degli androgeni.
È generalmente accettato che ogni persona debba essere regolarmente testata per il colesterolo, ma questo studio non può essere definito informativo e, se necessario, il medico può prescrivere al paziente un test che riflette lo spettro lipidico del sangue, la cui decodifica è molto importante . E quando un paziente riceve un rinvio da un medico per un esame, potrebbe incontrare una frase a lui sconosciuta: profilo lipidico nel sangue. In questo caso, una persona ha molte domande: cos'è, perché preleva il sangue per il profilo lipidico, come viene eseguita un'analisi dettagliata. Infatti, un profilo lipidico è un esame del sangue di laboratorio che consente di identificare tempestivamente pericolose anomalie nel metabolismo dei grassi che possono causare lo sviluppo di patologie associate al cuore e ai vasi sanguigni.
Quando è necessario che una persona faccia un test lipidico?

La decodifica del profilo lipidico consente al medico di riconoscere informazioni complete e veritiere sullo stato di salute del paziente, nonché di determinare il possibile rischio di sviluppare condizioni patologiche gravi. A sua volta, un esame del sangue per il colesterolo non è così informativo e viene utilizzato solo come test di screening o per valutare l'efficacia del trattamento.
Le principali indicazioni per eseguire un profilo lipidico sono:

- esame regolare delle persone la cui età ha oltrepassato il confine di 20 anni - una volta ogni 5 anni;
- la presenza di fattori di rischio in una persona: stile di vita inadeguato, fumo, eccesso di peso, sviluppo del diabete mellito, età superiore a 45 anni;
- aumento del livello di colesterolo totale, che può essere determinato dal tasso alcolemico;
- eredità sfavorevole - se i parenti di una persona hanno malattie cardiache e vascolari, diabete, infarto o ictus (in questo caso gli esami devono essere eseguiti molto più spesso);
- monitoraggio costante dell'efficacia della terapia farmacologica somministrata al paziente, che viene effettuata utilizzando statine o farmaci ipolipemizzanti;
- cambiamenti precoci nella quantità di colesterolo nel corpo umano.
Questi fattori spiegano la necessità di condurre uno studio sul flusso sanguigno per determinare la quantità di lipidi.
Come donare il sangue per la determinazione dei lipidi
Lo spettro lipidico del sangue è piuttosto sensibile al danno causato da fattori esterni (e l'assunzione di specifici tipi di cibo non è l'unico). Il risultato finale di questa analisi è influenzato e influenzato negativamente dall'aumento dello stress sul corpo, dalla frequente depressione e ansia, dall'uso di composti medicinali, malattie infettive e altri fattori che devono essere presi in considerazione quando si decifrano i risultati finali.
Il prelievo di sangue per gli esami dovrebbe essere effettuato solo al mattino. In questo caso, devi mangiare cibo 12 ore prima di donare il sangue. Mezz'ora prima del test si consiglia di eliminare completamente il fumo, l'assunzione di liquidi diversi dall'acqua, nonché lo stress sul corpo (sia fisico che mentale). Va ricordato che un esame del sangue per i lipidi non deve essere eseguito su persone che soffrono di infarto nei primi 3 mesi dopo l'inizio del suo sviluppo.

L’ottenimento di risultati reali può essere influenzato da:
- lesioni legate al funzionamento degli organi interni o all'integrità ossea;
- esercizio fisico;
- stadio acuto delle malattie infettive;
- gravidanza;
- esaurimento, fame;
- l'uso di cattive abitudini poco prima dell'analisi;
- malattie concomitanti con danni ai reni, alle ghiandole e al fegato.
Poiché la maggior parte dei farmaci può aumentare o diminuire la quantità di colesterolo, è necessario informarne il medico quando si assumono farmaci specifici.
Inoltre, i seguenti fattori possono modificare i risultati o influenzarne la correttezza, il che alla fine porterà a un esame del sangue errato per il profilo lipidico:
- pressione arteriosa;
- metabolismo alterato;
- essere sovrappeso;
- predisposizione genetica alle malattie associate ai vasi sanguigni e al cuore.
Quali sono gli indicatori del profilo lipidico?
Il processo del grasso che avviene nel corpo è particolarmente responsabile dello sviluppo di molte malattie. Ciò vale soprattutto per le patologie legate alla rete vascolare e al cuore. Dopotutto, ora quasi tutti sanno che alti livelli di colesterolo cattivo causano lo sviluppo dell'aterosclerosi, e questo porta già a ictus, compromissione del funzionamento dei reni e del fegato, infarto dell'aorta e degli arti.

Sicuramente molte persone capiscono che la quantità di colesterolo nel sangue è considerata un indicatore particolarmente importante del metabolismo dei grassi e un aumento del suo livello dovrebbe sempre allertare una persona. Tuttavia, questo risultato spesso non è sufficiente, poiché nelle persone sane il livello di questa sostanza spesso aumenta, il che non porta all'aterosclerosi.
Per determinare in una fase precoce la presenza di patologie associate ai vasi sanguigni e al cuore, nonché per evitare stadi di aterosclerosi pericolosi per la salute, è importante condurre un esame del sangue per lo spettro lipidico, che mostra tutto violazioni della norma. Vale la pena sapere che durante l'esecuzione del test del colesterolo, il profilo lipidico mostrerà comunque deviazioni significative anche se il risultato non va oltre il range di normalità.
Ma oltre al colesterolo (CH), questa analisi riflette anche alcuni indicatori del sangue, che includono:
- Trigliceridi (TG).
- HDL o comunque colesterolo “buono”.
- LDL o l’elemento “cattivo”.
- Le VLDL sono lipoproteine che hanno una densità molto bassa.
La cosa principale è consultare un medico in tempo e condurre un esame del sangue che identificherà con precisione lo sviluppo di una particolare malattia.
Risultati dell'interpretazione dello spettro lipidico nel sangue
La decifrazione dei risultati ottenuti dovrebbe essere eseguita solo da uno specialista che è obbligato a tenere conto di tutti i fattori collaterali che possono avere particolare attenzione al risultato finale. Durante l'esecuzione del lavoro, il medico determina se il paziente presenta deviazioni nei risultati rispetto alla norma generalmente accettata. Si ritiene che il paziente abbia un grave rischio di aterosclerosi quando i livelli di colesterolo superano la norma. Lo sviluppo della patologia si può notare anche dal coefficiente aterogenico, che diventa superiore a 3, così come dalla bassa quantità di HDL.
 Il profilo lipidico normale è il seguente risultato:
Il profilo lipidico normale è il seguente risultato:
- KA – 2,2-3,5;
- TG – non più di 2,25 mmol/l;
- HDL – 1,03-1,55 mmol/l;
- LDL – non più di 3,3 mmol/l;
- VLDL – 0,13-1,63 mmol/l;
- il livello di colesterolo non supera 5,2 mmol/l.
Vale la pena sapere che per le donne e gli uomini esiste una norma diversa per le lipoproteine ad alta densità. Pertanto, quando decifra i test, il medico deve prestare estrema attenzione, poiché il loro risultato dipende da molti fattori.
Il coefficiente aterogenico può anche indicare la presenza di un aumento dei livelli di colesterolo in una persona:
- Se il suo valore non supera 3, il rischio di malattie cardiache e vascolari può essere ridotto al minimo in modo sicuro.
- Con indicatori di 3-4 valori c'è un alto rischio di sviluppare malattie pericolose per la salute.
- Se il valore supera 5, il paziente sta già sperimentando varie manifestazioni di aterosclerosi, vale a dire cardiopatia ischemica, malattia renale, encefalopatia discircolatoria, deterioramento del flusso sanguigno negli arti inferiori.
Se l'analisi dello spettro lipidico dà un risultato positivo, in cui si possono notare aumenti degli indicatori aterogenici, il paziente può sviluppare patologie come:
- IHD che causa gravi cambiamenti nelle arterie coronarie;
- pancreatite;
- obesità;
- diabete;
- patologie degli organi urinari;
- malattie del fegato (cirrosi, epatite);
- forme ereditarie di iper- e dislipidemia;
- deterioramento della produzione di ormoni prodotti dalla ghiandola tiroidea;
- gravidanza – c’è un aumento fisiologico della quantità di colesterolo nel corpo.
L’abbassamento del colesterolo è possibile nei seguenti casi:

- neoplasie maligne;
- tireotossicosi;
- ustioni;
- fame;
- malattie infettive;
- malattie del sistema polmonare.
Il livello delle lipoproteine ad alta densità diminuisce molto spesso in caso di cardiopatia ischemica, infarto, ulcere gastrointestinali e diabete.
È importante sapere che anche l'alimentazione umana può influenzare i livelli di questo componente nel corpo. E se il paziente non ha ancora l'aterosclerosi, i primi cambiamenti nei livelli lipidici indicano già che nel corpo si sono sviluppate malattie associate ai vasi sanguigni e al cuore.
L'abuso di cibi fritti e grassi, nonché di bevande alcoliche, crea un aumento del carico di colesterolo sul corpo, che non è in grado di elaborare completamente.
Dopo qualche tempo, il suo eccesso si deposita alla base dei vasi sanguigni sotto forma di placche e porta al loro restringimento e quindi al blocco.
Dovrebbero sottoporsi a questo test anche i pazienti i cui livelli di colesterolo sono normali, soprattutto se sono a rischio. Con un'ereditarietà non molto buona, è importante donare il sangue regolarmente, almeno una volta all'anno (dipende principalmente dall'età della persona). Poiché questo test è considerato attualmente noto, i medici non incontrano particolari difficoltà nell'eseguirlo.
Metabolismo dei lipidi: suoi disturbi e trattamento
Il metabolismo dei lipidi è il metabolismo dei lipidi; è un complesso processo fisiologico e biochimico che si verifica nelle cellule degli organismi viventi. I lipidi neutri come il colesterolo e i trigliceridi (TG) sono insolubili nel plasma. Di conseguenza, i lipidi circolanti nel sangue sono attaccati alle proteine che li trasportano ai vari tessuti per l’utilizzo dell’energia, la deposizione come tessuto adiposo, la produzione di ormoni steroidei e la formazione di acidi biliari.
Una lipoproteina è composta da un lipide (la forma esterificata o non esterificata di colesterolo, trigliceridi e fosfolipidi) e una proteina. I componenti proteici della lipoproteina sono noti come apolipoproteine e apoproteine. Varie apolipoproteine sono fattori coenzimatici e ligandi dei recettori.
Il metabolismo dei lipidi è diviso in due principali vie metaboliche: endogena ed esogena. Questa divisione si basa sull'origine dei lipidi in questione. Se la fonte dei lipidi è il cibo, allora stiamo parlando di una via metabolica esogena e se il fegato è endogeno. Esistono diverse classi di lipidi, ciascuna delle quali è caratterizzata da una funzione separata. Esistono chilomicroni (CM), lipoproteine a densità molto bassa (VLDL), lipoproteine a densità intermedia (IDL), lipoproteine a bassa densità (LDL) e lipoproteine ad alta densità (HDL). Il metabolismo delle singole classi di lipoproteine non è indipendente; sono tutte strettamente correlate. Comprendere il metabolismo dei lipidi è importante per un'adeguata comprensione della fisiopatologia delle malattie cardiovascolari (CVD) e dei meccanismi di azione dei farmaci.

Colesterolo e trigliceridi sono richiesti dai tessuti periferici per una varietà di aspetti dell’omeostasi, compreso il mantenimento delle membrane cellulari, la sintesi degli ormoni steroidei e degli acidi biliari e l’utilizzo dell’energia. Considerando che i lipidi non possono dissolversi nel plasma, vengono trasportati da diverse lipoproteine che circolano nel sistema circolatorio.
La struttura di base di una lipoproteina comprende solitamente un nucleo costituito da colesterolo e trigliceridi esterificati, circondato da un doppio strato di fosfolipidi, oltre a colesterolo non esterificato e varie proteine chiamate apolipoproteine. Queste lipoproteine differiscono per dimensione, densità e composizione di lipidi, apolipoproteine e altre caratteristiche. È significativo che le lipoproteine abbiano qualità funzionali diverse (Tabella 1).
Tabella 1. Indicatori del metabolismo lipidico e caratteristiche fisiche delle lipoproteine nel plasma.
Le principali classi di lipoproteine, ordinate per dimensione decrescente delle particelle:
- VLDL,
- LPSP,
- LDL,
- HDL.
I lipidi alimentari entrano nel sistema circolatorio legandosi all’apolipoproteina (apo) B48, che contiene chilomicroni sintetizzati nell’intestino. Il fegato sintetizza VLDL1 e VLDL2 attorno a apoB100, attirando i lipidi presenti nel sistema circolatorio (acidi grassi liberi) o nella dieta (chilomicroni residui). VLDL1 e VLDL2 vengono poi delipidati dalla lipoproteina lipasi, rilasciando acidi grassi per il consumo da parte del muscolo scheletrico e del tessuto adiposo. VLDL1, liberando lipidi, viene convertito in VLDL2, VLDL2 viene ulteriormente trasformato in LPSP. I chilomicroni residui, LPSP e LDL possono essere assorbiti dal fegato attraverso il recettore.
Le lipoproteine ad alta densità si formano nello spazio intercellulare, dove l'apoAI entra in contatto con i fosfolipidi, il colesterolo libero e forma una particella HDL a forma di disco. Successivamente, questa particella interagisce con la lecitina e si formano esteri di colesterolo, che formano il nucleo HDL. Il colesterolo viene infine consumato dal fegato e l'apoAI viene secreto dall'intestino e dal fegato.
Le vie metaboliche dei lipidi e delle lipoproteine sono strettamente interconnesse. Nonostante esistano numerosi farmaci efficaci che riducono i lipidi nel corpo, il loro meccanismo d’azione rimane ancora poco compreso. È necessario un ulteriore chiarimento dei meccanismi molecolari d’azione di questi farmaci per migliorare la qualità del trattamento della dislipidemia.
Caratteristiche generali del metabolismo lipidico
- Le statine aumentano la velocità di eliminazione di VLDL, LPSP e LDL e riducono anche l'intensità della sintesi di VLDL. Ciò alla fine migliora il profilo lipoproteico.
- I fibrati accelerano la rimozione delle particelle di apoB e intensificano la produzione di apoAI.
- L'acido nicotinico riduce LDL e TG e aumenta anche il contenuto di HDL.
- Ridurre il peso corporeo aiuta a ridurre la secrezione di VLDL, che migliora il metabolismo delle lipoproteine.
- La regolazione del metabolismo dei lipidi è ottimizzata dagli acidi grassi omega-3.
Disturbi genetici
La scienza conosce tutta una serie di malattie dilipidemiche ereditarie, in cui il difetto principale è la regolazione del metabolismo lipidico. La natura ereditaria di queste malattie è in alcuni casi confermata da studi genetici. Queste malattie vengono spesso identificate attraverso uno screening lipidico precoce.
Un breve elenco di forme genetiche di dislipidemia.
Ipercolesterolemia:
- Ipercolesterolemia familiare.
- ApoB100 difettoso ereditario.
- Ipercolesterolemia poligenica.
Ipertrigliceridemia:
- Ipertrigliceridemia familiare.
- Iperchilomicronemia familiare.
- Mancanza di lipoproteina lipasi.
Disturbi nel metabolismo delle HDL:
- Ipoalfalipoproteinemia familiare.
- Svantaggio dell'LCAT.
- Mutazioni puntiformi di apoA-l.
- Carenza di ABCA1.
Forme combinate di iperlipidemia:
- Iperlipidemia combinata familiare.
- Iperbetalipoproteinemia.
- Disbetalipoproteinemia familiare.
Ipercolesterolemia
L'ipercolesterolemia familiare è una malattia monozigote, autosomica dominante, che comporta un'espressione difettosa e un'attività funzionale del recettore LDL. L'espressione eterozigote di questa malattia tra la popolazione è osservata in un caso su cinquecento. Sono stati identificati vari fenotipi sulla base di difetti nella sintesi, nel traffico e nel legame dei recettori. Questo tipo di ipercolesterolemia familiare è associata ad aumenti significativi del colesterolo LDL, alla presenza di xantomi e allo sviluppo prematuro di aterosclerosi diffusa.
Le manifestazioni cliniche sono più pronunciate nei pazienti con mutazioni omozigoti. La diagnosi di disturbi del metabolismo lipidico viene spesso posta sulla base di una grave ipercolesterolemia con TG normali e presenza di xantomi tendinei, nonché in presenza di un'anamnesi familiare di CVD precoce. I metodi genetici vengono utilizzati per confermare la diagnosi. Il trattamento utilizza alte dosi di statine oltre ai farmaci. In alcuni casi è necessaria l’aferesi delle LDL. Ulteriori prove provenienti da recenti ricerche supportano l’uso della terapia intensiva per bambini e adolescenti ad alto rischio. Ulteriori opzioni terapeutiche per i casi complessi comprendono il trapianto di fegato e la terapia di sostituzione genica.
ApoB100 difettoso ereditario
I difetti ereditari nel gene apoB100 sono una malattia autosomica che provoca anomalie lipidiche che ricordano l'ipercolesterolemia familiare. La gravità clinica e l’approccio al trattamento di questa malattia sono simili a quelli dell’ipercolesterolemia familiare eterozigote. La colesterolemia poligenica è caratterizzata da un moderato aumento delle LDL, dei TG normali, di un'aterosclerosi precoce e dell'assenza di xantomi. Difetti tra cui l’aumento della sintesi di apoB e la diminuzione dell’espressione dei recettori possono portare a livelli elevati di colesterolo LDL.
Ipertrigliceridemia
L'ipertrigliceridemia familiare è una malattia autosomica dominante caratterizzata da livelli elevati di trigliceridi combinati con resistenza all'insulina e incapacità di regolare la pressione sanguigna e i livelli di acido urico. Le mutazioni nel gene della lipoproteina lipasi che sono alla base di questa malattia sono responsabili del grado di aumento dei livelli di trigliceridi.
L'iperchilomicronemia familiare è una forma estesa di mutazione della lipoproteina lipasi che porta a una forma più complessa di ipertrigliceridemia. Il deficit della lipoproteina lipasi è associato a ipertrigliceridemia e aterosclerosi precoce. Questa malattia richiede una riduzione dell'assunzione di grassi e l'uso di una terapia farmacologica per ridurre i TG. È anche necessario smettere di bere alcolici, combattere l'obesità e curare intensamente il diabete.
Disturbi nel metabolismo delle lipoproteine ad alta densità
L'ipoalfalipoproteinemia familiare è una malattia autosomica rara che comporta mutazioni nel gene apoA-I e porta ad una diminuzione delle lipoproteine ad alta densità e ad aterosclerosi precoce. Il deficit di lecitina colesterolo aciltransferasi è caratterizzato da un'esterificazione difettosa del colesterolo sulla superficie delle particelle HDL. Il risultato sono bassi livelli di HDL. In numerosi casi sono state descritte varie mutazioni genetiche dell'apoA-I che comportano sostituzioni di singoli aminoacidi.
L'anfalipoproteinemia è caratterizzata dall'accumulo di lipidi cellulari e dalla presenza di cellule schiumose nei tessuti periferici, nonché da epatosplenomegalia, neuropatia periferica, bassi livelli di HDL e aterosclerosi precoce. Questa malattia è causata da mutazioni nel gene ABCA1, che portano all'accumulo cellulare di colesterolo. L’aumento della clearance renale dell’apoA-I contribuisce alla riduzione delle lipoproteine ad alta densità.
Forme combinate di iperlipidemia
L'incidenza dell'iperlipidemia combinata familiare può raggiungere il 2% nella popolazione. È caratterizzato da livelli elevati di apoB, LDL e trigliceridi. Questa malattia è causata dall'eccessiva sintesi di apoB100 nel fegato. La gravità della malattia in un particolare individuo è determinata dalla relativa mancanza di attività della lipoproteina lipasi. L’iperbetalipoproteinemia è un tipo di iperlipidemia familiare. Le statine sono comunemente usate per trattare questa malattia in combinazione con altri farmaci, tra cui niacina, sequestranti degli acidi biliari, ezetimibe e fibrati.
La disbetalipoproteinemia familiare è una malattia autosomica recessiva caratterizzata dalla presenza di due alleli apoE2, nonché da livelli elevati di colesterolo LDL, xantomi e sviluppo precoce di malattie cardiovascolari. La mancata eliminazione delle VLDL e dei chilomicroni residui porta alla formazione di particelle VLDL (beta-VLDL). Poiché questa malattia è pericolosa per lo sviluppo di malattie cardiovascolari e pancreatite acuta, è necessaria una terapia intensiva per ridurre i trigliceridi.
Disturbi del metabolismo lipidico – caratteristiche generali
- Le malattie ereditarie dell’omeostasi delle lipoproteine portano a ipercolesterolemia, ipertrigliceridemia e bassi livelli di HDL.
- Nella maggior parte di questi casi, vi è un aumento del rischio di malattie cardiovascolari precoci.
- La diagnosi dei disturbi metabolici comprende lo screening precoce utilizzando i lipidogrammi, che rappresentano una misura adeguata per la diagnosi precoce dei problemi e l'inizio della terapia.
- Per i parenti stretti dei pazienti, si raccomanda lo screening utilizzando i profili lipidici, a partire dalla prima infanzia.
Cause secondarie che contribuiscono ai disturbi del metabolismo lipidico
Un piccolo numero di casi di livelli anomali di LDL, TG e HDL sono causati da problemi medici e farmaci di base. Il trattamento di queste cause di solito porta alla normalizzazione del metabolismo lipidico. Di conseguenza, per i pazienti con dislipidemia, è necessario un esame per la presenza di cause secondarie di disturbi del metabolismo lipidico.
La valutazione delle cause secondarie dei disturbi del metabolismo lipidico dovrebbe essere effettuata durante l'esame iniziale. L'analisi delle condizioni iniziali dei pazienti con dislipidemia dovrebbe includere una valutazione della ghiandola tiroidea, nonché degli enzimi epatici, della glicemia e dei parametri biochimici delle urine.
Disturbi del metabolismo lipidico nel diabete mellito
Il diabete è accompagnato da ipertrigliceridemia, bassi livelli di HDL e presenza di particelle LDL piccole e dense. In questo caso si notano resistenza all'insulina, obesità, aumento dei livelli di glucosio e di acidi grassi liberi e diminuzione dell'attività della lipoproteina lipasi. Il controllo glicemico intensivo e la riduzione dell’obesità centrale possono avere un effetto positivo sui livelli dei lipidi totali, soprattutto in presenza di ipertrigliceridemia.
I disturbi dell'omeostasi del glucosio osservati nel diabete sono accompagnati da ipertensione e dislipidemia, che portano a fenomeni aterosclerotici nel corpo. La malattia coronarica è il fattore più importante di mortalità nei pazienti con diabete mellito. L'incidenza di questa malattia è 3-4 volte maggiore nei pazienti con diabete non insulino-dipendente rispetto alla norma. La terapia farmacologica per abbassare le LDL, in particolare le statine, è efficace nel ridurre la gravità della malattia cardiovascolare nei diabetici.
Ostruzione biliare
La colelitiasi cronica e la cirrosi biliare primitiva sono associate a ipercolesterolemia attraverso lo sviluppo di xantomi e l'aumento della viscosità del sangue. Il trattamento dell’ostruzione del dotto biliare può aiutare a normalizzare il metabolismo dei lipidi. Sebbene i farmaci ipolipemizzanti standard possano essere solitamente utilizzati per l’ostruzione biliare, le statine sono generalmente controindicate nei pazienti con malattia epatica cronica o colelitiasi. La plasmaforesi può essere utilizzata anche per trattare lo xantoma sintomatico e l'iperviscosità.
Malattie renali
L’ipertrigliceridemia è comune nei pazienti affetti da insufficienza renale cronica. Ciò è in gran parte dovuto alla diminuzione dell’attività della lipoproteina lipasi e della lipasi epatica. Livelli anormali di trigliceridi sono comunemente osservati nei soggetti sottoposti a trattamento di dialisi peritoneale. È stato suggerito che un ridotto tasso di eliminazione dei potenziali inibitori della lipasi svolga un ruolo chiave nello sviluppo di questo processo. C'è anche un aumento del livello di lipoproteina (a) e un basso livello di HDL, che porta ad uno sviluppo accelerato di CVD. Le ragioni secondarie che contribuiscono allo sviluppo dell'ipertrigliceridemia includono:
- Fallimento renale cronico
- Obesità
- Sindrome nevrotica
- sindrome di Cushing
- Lipodistrofia
- Fumare tabacco
- Consumo eccessivo di alcol
- Eccessivo apporto di carboidrati
È stato effettuato un tentativo attraverso studi clinici per chiarire gli effetti della terapia ipolipemizzante nei pazienti con malattia renale allo stadio terminale. Questi studi hanno dimostrato che l’atorvastatina non ha ridotto l’endpoint composito di CVD, infarto miocardico e ictus. È stato inoltre notato che la rosuvastatina non ha ridotto l’incidenza di malattie cardiovascolari nei pazienti sottoposti a regolare emodialisi.
La sindrome nefrosica è associata ad un aumento dei TG e della lipoproteina (a), causato dall'aumento della sintesi di apoB da parte del fegato. Il trattamento della sindrome nefrosica si basa sull'eliminazione dei problemi sottostanti e sulla normalizzazione dei livelli lipidici. L’uso della terapia ipolipemizzante standard può essere efficace, ma è necessario un monitoraggio costante dei possibili effetti collaterali.
Malattie della tiroide
L'ipotiroidismo è accompagnato da livelli elevati di LDL e trigliceridi e il grado in cui si discostano dalla norma dipende dall'entità dei problemi alla tiroide. La ragione di ciò è una diminuzione dell’espressione e dell’attività del recettore LDL, nonché una diminuzione dell’attività della lipoproteina lipasi. L’ipertiroidismo di solito si manifesta con bassi livelli di LDL e TG.
Obesità
L’obesità centrale è accompagnata da un aumento dei livelli di VLDL e trigliceridi, nonché da bassi livelli di HDL. La perdita di peso e gli aggiustamenti dietetici portano a effetti positivi sui livelli di trigliceridi e HDL.
Farmaci
Molti farmaci concomitanti causano lo sviluppo di dislipidemia. Per questo motivo, la valutazione iniziale dei pazienti con anomalie lipidiche dovrebbe essere accompagnata da un’attenta considerazione dei farmaci.
Tabella 2. Farmaci che influenzano i livelli lipidici.
I diuretici tiazidici e i beta-bloccanti, se assunti, spesso causano ipertrigliceridemia e bassi livelli di HDL. Gli estrogeni esogeni e il progesterone, che fanno parte dei componenti della terapia ormonale sostitutiva e dei contraccettivi orali, causano ipertrigliceridemia e diminuzione dell'HDL. I farmaci antiretrovirali per i pazienti affetti da HIV sono accompagnati da ipertrigliceridemia, aumento delle LDL, resistenza all'insulina e lipodistrofia. Anche gli steroidi anabolizzanti, i corticosteroidi, la ciclosporina, il tamoxifene e i retinoidi causano anomalie del metabolismo dei lipidi quando utilizzati.
Trattamento dei disturbi del metabolismo lipidico
Correzione del metabolismo lipidico
Il ruolo dei lipidi nella patogenesi della CVD aterosclerotica è stato ben studiato e dimostrato. Ciò ha portato ad una ricerca attiva di modi per ridurre il livello di lipidi aterogenici e migliorare le proprietà protettive dell'HDL. Gli ultimi cinquant’anni sono stati caratterizzati dallo sviluppo di un’ampia gamma di approcci dietetici e farmacologici per correggere il metabolismo dei lipidi. Molti di questi approcci hanno contribuito a ridurre il rischio di malattie cardiovascolari, il che ha portato alla diffusa introduzione di questi farmaci nella pratica (Tabella 3).
Tabella 3. Principali classi di farmaci utilizzati per trattare i disturbi del metabolismo lipidico.
Lipoproteine a bassa densità
Le LDL svolgono un ruolo chiave nella formazione e nell’espressione clinica della malattia coronarica. Nella prima parte della vita adulta, lo screening per la dislipidemia ereditaria richiede la valutazione dei suoi livelli ematici. La riduzione del colesterolo LDL attraverso cambiamenti nello stile di vita e la terapia farmacologica è il pilastro della prevenzione delle malattie cardiovascolari. Il grado di riduzione richiesto dipende dallo stato di salute generale del paziente. La ricerca medica suggerisce che la terapia farmacologica ipolipemizzante dovrebbe essere iniziata il più presto possibile nei pazienti a maggior rischio.
Lipoproteine ad alta densità
L’HDL ha un effetto protettivo nel ridurre il rischio di CVD. Il monitoraggio della dinamica di questo composto nel sangue è un elemento importante del controllo della CVD. Attualmente si stanno compiendo sforzi sostanziali per sviluppare farmaci che aumenteranno significativamente l’HDL nel sangue. Sebbene gli obiettivi per i livelli di HDL non siano attualmente disponibili, molti esperti raccomandano un obiettivo di 40 mg/dl per gli uomini e 50 mg/dl per le donne.
Trigliceridi
La ricerca suggerisce che i trigliceridi aumentano il rischio di sviluppare una malattia coronarica. La relazione inversa tra trigliceridi e anomalie metaboliche complica l’analisi del contributo di questi composti allo sviluppo della malattia coronarica. I cambiamenti dello stile di vita, inclusa la riduzione del peso e della circonferenza della vita, sono fondamentali per il successo del trattamento. Il trattamento farmacologico prevede spesso una combinazione di statine e altri farmaci. Il monitoraggio del processo terapeutico e la diagnosi dei disturbi del metabolismo lipidico dovrebbero essere utilizzati anche durante il trattamento farmacologico.
Trattamento con rimedi popolari
Gli steroli e gli stanoli vegetali, utilizzati nella medicina popolare, esercitano un'inibizione competitiva sull'assorbimento del colesterolo. Tuttavia, la loro bassa solubilità in acqua porta alla necessità di includere questi composti in altri componenti, ad esempio quelli contenenti acidi grassi. Il consumo di integratori alimentari contenenti steroli può ridurre i livelli di lipidi.
È noto che vari componenti alimentari influenzano i livelli di lipidi nel corpo umano. Ad esempio, gli isoflavoni presenti nei prodotti a base di soia possono abbassare l’LDL e prevenire l’ossidazione di questo tipo di colesterolo. In alcuni casi, nella medicina alternativa vengono utilizzati estratti di aglio e altre piante (ad esempio il policosanolo). Esistono prove interessanti che le monacoline, presenti nel riso rosso fermentato, possono aiutare a ridurre l’LDL. Tuttavia, l’efficacia di questi farmaci necessita ancora di prove scientifiche.
La dieta per i disturbi del metabolismo lipidico è di grande importanza terapeutica. Le diete ricche di noci e fibre aiutano anche a ridurre il colesterolo. Uno dei benefici dell'estratto di tè verde è la normalizzazione del metabolismo delle lipoproteine.
Caratteristiche generali del trattamento dei disturbi del metabolismo lipidico
La diffusione attiva del diabete mellito in tutto il mondo contribuisce in modo significativo alla diffusione delle malattie cardiovascolari. L’alterata omeostasi del glucosio, insieme all’ipertensione arteriosa e alla dislipidemia, influenza la formazione e la progressione dell’aterosclerosi nel diabete. La tipica dislipidemia associata al diabete non insulino-dipendente è caratterizzata da trigliceridi elevati e basse lipoproteine ad alta densità. L’uso delle statine per normalizzare il metabolismo dei lipidi è efficace nel prevenire i rischi di malattie cardiovascolari nei pazienti con diabete.
Tipi di dislipidemia e cause della sua insorgenza

Disturbo del metabolismo dei grassi


- iperlipidemia endogena;
Cause

- diabete;
- colelitiasi;
- colecistite;
- epatite;
- cattiva alimentazione;
- fumare;
- stile di vita passivo.

- situazioni stressanti;
- lavoro sedentario;
- ipertensione persistente;
- ampia circonferenza della vita;
- età superiore a 45 anni;
- storia famigliare;

- xantomi;
- xantelasma.

Sondaggio

- Evitare di applicare un laccio emostatico.
Tattiche di trattamento

- normalizzazione del peso;
- dosaggio del carico;
- dieta;
- rinunciare ad alcol e sigarette.

- fibrati;
- statine.
Konstantin Il'ic Bulyshev

- Mappa del sito
- Analizzatori del sangue
- Analisi
- Aterosclerosi
- Medicinali
- Trattamento
- Metodi tradizionali
- Nutrizione
I disturbi metabolici nel corpo umano includono la dislipidemia. Questa è una condizione patologica in cui la normale composizione lipidica del sangue cambia. Questa non è una malattia indipendente. L’iperlipoproteinemia è un importante fattore di rischio per lo sviluppo dell’aterosclerosi.

Disturbo del metabolismo dei grassi
I disturbi del metabolismo dei lipidi sono molto comuni. Questa patologia viene diagnosticata principalmente negli adulti. Il corpo umano sintetizza trigliceridi, colesterolo e lipoproteine. Questi ultimi sono formati da proteine e grassi. Esistono lipoproteine a densità alta, bassa, intermedia e molto bassa. Oltre a questi composti, ci sono i chilomicroni.
Le lipoproteine sono essenziali per il trasporto del colesterolo e la costruzione cellulare. Quando il metabolismo dei grassi viene interrotto, il rapporto tra queste sostanze cambia e la loro formazione aumenta. Esiste una cosa chiamata iperlipoproteinemia. Questo è un alto livello di lipoproteine nel sangue. È un fattore di rischio per lo sviluppo di patologie cardiovascolari (malattia coronarica, aterosclerosi, ipertensione).
 Ogni anno decine di milioni di persone muoiono a causa di questa malattia. Normalmente, il livello di colesterolo di una persona sana non supera i 5,2 mmol/l. La concentrazione di questa sostanza è considerata elevata se è superiore a 6,2 mmol/l. Il livello ottimale di trigliceridi nel sangue è inferiore a 1,7 mmol/l. Le lipoproteine a bassa densità sono aterogene. Aumentano la probabilità di sviluppare l’aterosclerosi.
Ogni anno decine di milioni di persone muoiono a causa di questa malattia. Normalmente, il livello di colesterolo di una persona sana non supera i 5,2 mmol/l. La concentrazione di questa sostanza è considerata elevata se è superiore a 6,2 mmol/l. Il livello ottimale di trigliceridi nel sangue è inferiore a 1,7 mmol/l. Le lipoproteine a bassa densità sono aterogene. Aumentano la probabilità di sviluppare l’aterosclerosi.
Normalmente la loro concentrazione nel sangue è inferiore a 2,6 mmol/l. Una condizione limite è quando il livello di LDL è 3,4–4 mmol/l. Le lipoproteine ad alta densità sono antiaterogeniche. La loro bassa concentrazione costituisce un fattore di rischio per lo sviluppo di patologie cardiovascolari. Il contenuto HDL ottimale è 1,6 mmol/l o superiore.
Tipi di disturbi del metabolismo lipidico
I medici esperti conoscono tutti i tipi di iperlipidemia. Questa patologia può essere primaria, secondaria e nutrizionale. Nel primo caso, i disturbi sono causati da fattori congeniti (genetici). La forma poligenica primaria di questa patologia viene spesso diagnosticata. Il tipo secondario si sviluppa sullo sfondo di altre malattie. Nutrizionale - grazie ad una dieta equilibrata.

Esiste una classificazione dell'iperlipoproteinemia a seconda di quali composti sono elevati. Secondo Fredrickson si distinguono i seguenti tipi:
- iperchilomicronemia ereditaria;
- ipercolesterolemia ereditaria e poligenica;
- iperlipidemia combinata;
- dis-beta lipoproteinemia ereditaria;
- iperlipidemia endogena;
- ipertrigliceridemia ereditaria.
Ci sono 5 tipi in totale. La seconda forma si divide nelle tipologie 2a e 2b. Il disturbo del metabolismo dei grassi di tipo 2a è caratterizzato da un'elevata concentrazione di LDL nel sangue. Con la forma 2b aumenta il contenuto di trigliceridi, VLDL e LDL. Nel tipo 3 c'è un'alta concentrazione di LDL. La forma 4 di questa patologia è caratterizzata da un aumento del livello di VLDL nel sangue. Nel tipo 5 la sintesi dei chilomicroni è ulteriormente potenziata.
Cause
 Questi cambiamenti si verificano per diversi motivi. I principali fattori eziologici sono:
Questi cambiamenti si verificano per diversi motivi. I principali fattori eziologici sono:
- eredità di geni difettosi dai genitori;
- diabete;
- produzione insufficiente di ormoni tiroidei;
- intervento chirurgico alla tiroide;
- colelitiasi;
- colecistite;
- epatite;
- assumere alcuni farmaci;
- cattiva alimentazione;
- fumare;
- fallimento renale cronico;
- stile di vita passivo.
 L'uso incontrollato di immunosoppressori, beta bloccanti, diuretici tiazidici, farmaci ormonali, retinoidi e farmaci ormonali (estrogeni, corticosteroidi) ha un effetto negativo sul metabolismo dei grassi. L’iperlipidemia diabetica è comune. Si osserva nelle persone il cui apporto calorico supera la norma.
L'uso incontrollato di immunosoppressori, beta bloccanti, diuretici tiazidici, farmaci ormonali, retinoidi e farmaci ormonali (estrogeni, corticosteroidi) ha un effetto negativo sul metabolismo dei grassi. L’iperlipidemia diabetica è comune. Si osserva nelle persone il cui apporto calorico supera la norma.
La forma secondaria di iperlipidemia si osserva sullo sfondo della sindrome nefrosica. Il gruppo a rischio comprende le donne incinte. Spesso viene diagnosticata la forma nutrizionale della dislipidemia. È causato da un eccesso di cibi grassi nella dieta (maiale, panna acida, burro, salsicce, frattaglie), eccesso di cibo e abuso di dolciumi e prodotti da forno.
I fattori predisponenti sono:
- situazioni stressanti;
- lavoro sedentario;
- ipertensione persistente;
- ampia circonferenza della vita;
- età superiore a 45 anni;
- storia famigliare;
- presenza di ictus o malattia coronarica.

Questa patologia è più comune negli uomini.
Manifestazioni di disturbi del metabolismo dei grassi
Non ci sono sintomi specifici per l’iperlipidemia. Questo è un indicatore di laboratorio, non una malattia. Quando la composizione lipidica del sangue cambia, sono possibili i seguenti segni:
- anello giallastro o bianco nella cornea;
- xantomi;
- xantelasma.
Se la frazione aterogenica delle lipoproteine aumenta, può svilupparsi xantomatosi. Colpisce le palpebre. Gli xantelasmi sono formazioni gialle, rotonde o ovali. Si alzano sopra la pelle. Questa condizione si sviluppa più spesso nelle persone con dislipidemia di tipo 2 e 3. Il gruppo a rischio comprende le donne anziane. A volte, quando il metabolismo dei lipidi è disturbato, si osserva un annebbiamento della cornea.
 I sintomi esterni di elevati livelli di lipidi nel sangue includono xantomi. Possono essere localizzati sui glutei, sulle cosce, sulle dita e anche nella zona articolare. Gli xantomi sono formati da trigliceridi, colesterolo e fagociti. Nella dislipidemia di tipo 2 e 3 compaiono spesso macchie gialle nella zona dei tendini. Gli xantomi piatti sono localizzati nelle pieghe della pelle.
I sintomi esterni di elevati livelli di lipidi nel sangue includono xantomi. Possono essere localizzati sui glutei, sulle cosce, sulle dita e anche nella zona articolare. Gli xantomi sono formati da trigliceridi, colesterolo e fagociti. Nella dislipidemia di tipo 2 e 3 compaiono spesso macchie gialle nella zona dei tendini. Gli xantomi piatti sono localizzati nelle pieghe della pelle.
Con questo disturbo è possibile lo sviluppo dell'aterosclerosi. Il quadro clinico è determinato dalla localizzazione del processo patologico. Sono possibili sintomi come mal di testa, debolezza, disfunzione intestinale, dolore toracico, dolore addominale, crampi, gonfiore e parestesia delle estremità. Con l'ipertrigliceridemia si sviluppa spesso la pancreatite. Si manifesta con dolore addominale, disturbi delle feci e gonfiore.
Sondaggio
Il trattamento dell'iperlipidemia inizia dopo che la diagnosi è stata chiarita. Per questo avrai bisogno di:

Se ci sono reclami soggettivi, possono essere necessarie la tomografia, l'angiografia, la scansione duplex, l'ecografia Doppler e l'elettrocardiografia. È molto importante stabilire i principali fattori di rischio per la dislipidemia. Questa sindrome di laboratorio viene rilevata durante un profilo lipidico.
Prima dello studio devi:
- seguire una dieta rigorosa per 2-3 settimane;
- curare le malattie infettive esistenti;
- Evitare di applicare un laccio emostatico.
Durante lo studio, il medico determina il contenuto di colesterolo totale, lipoproteine e trigliceridi.
Tattiche di trattamento
Per la dislipidemia secondaria, il trattamento è mirato alla malattia di base (diabete, patologia renale o tiroidea). La forma mista di questa patologia richiede un approccio integrato al trattamento.

Gli aspetti principali della terapia sono:
- normalizzazione del peso;
- dosaggio del carico;
- dieta;
- rinunciare ad alcol e sigarette.
L’iperlipidemia di qualsiasi grado è un’indicazione per modificare i modelli dietetici. I pazienti hanno bisogno di:

I seguenti farmaci possono essere prescritti in base alle indicazioni:
- inibitori dell'assorbimento del colesterolo;
- fibrati;
- preparati a base di acidi grassi polinsaturi;
- statine.
Questi farmaci abbassano i livelli di lipidi nel sangue. Le statine sono le più efficaci. Vengono prescritti Atorvastatina-Teva, Atoris, Vero-Lovastatina e Simvor. I metodi di trattamento extracorporeo sono ampiamente utilizzati. Questi includono l’immunoassorbimento, la filtrazione del plasma e l’emosorbimento. La dieta deve essere seguita costantemente.
I pazienti devono aumentare l'attività fisica, garantire un sonno notturno sufficiente ed eliminare le situazioni stressanti.
L'iperlipidemia non specificata, se non trattata, porta ad aterosclerosi e disturbi emodinamici. Pertanto, livelli elevati di lipoproteine sono spesso associati a una dieta povera e a una predisposizione ereditaria.
Cos'è la fermentopatia?
Enzimepatie- si tratta di malattie e condizioni patologiche causate da una completa mancanza di sintesi enzimatica o da un persistente deficit funzionale dei sistemi enzimatici di organi e tessuti.Enzimopatie ereditarie:
I disordini metabolici geneticamente determinati dovuti alla fermentopatia sono alla base di molte malattie ereditarie. In questo caso, il gene che controlla la sintesi della molecola proteica dell'enzima (apoenzima) può essere completamente assente, oppure l'apoenzima è sintetizzato, ma l'attività dell'enzima è assente o nettamente ridotta. Come risultato di mutazioni genetiche, la sequenza di aminoacidi nella struttura del centro attivo dell'enzima o nella regione in cui l'apoenzima si lega a un coenzima (molto spesso una vitamina o un metallo) può cambiare. Inoltre, è possibile sintetizzare molecole enzimatiche instabili e facilmente disintegrabili. Tutti questi cambiamenti nella struttura delle proteine enzimatiche sono chiamati malattie molecolari o patologia molecolare.Sono note più di 150 enzimopatie ereditarie, per le quali è stata stabilita l'essenza della mutazione genetica, sono stati identificati errori nella sintesi della molecola proteica dell'enzima e i corrispondenti geni mutanti sono stati mappati sui cromosomi (cioè la loro localizzazione è stato stabilito su uno dei 22 autosomi o sul cromosoma X). Circa il 75% delle mutazioni genetiche che portano allo sviluppo della fermentopatia sono sostituzioni di basi nella molecola del DNA, che portano ad un cambiamento nel codice genetico e, di conseguenza, alla sostituzione di un amminoacido con un altro nella catena polipeptidica dell'enzima.
La perdita della funzione catalitica dell'enzima crea un blocco metabolico della corrispondente reazione biochimica. Le manifestazioni patologiche del blocco possono essere associate all'accumulo di sostanze formatesi prima del blocco, oppure ad una carenza di prodotti di reazione che solitamente vengono sintetizzati a seguito dell'azione dell'enzima. Esiste un ampio gruppo di enzimopatie chiamate malattie da accumulo, o thesaurismosi, in cui le sostanze che sono precursori della reazione si depositano nelle cellule (ad esempio, glicogeno nella glicogenosi, glicoproteine, glicolipidi in alcune malattie lisosomiali, mucopolisaccaridi nelle mucopolisaccaridosi).
Molte condizioni patologiche sono causate da una carenza dei prodotti finali della reazione, interrotta a causa della fermentopatia, che porta ad una diminuzione della biosintesi degli ormoni (disfunzione congenita della corteccia surrenale, ipotiroidismo, ipoparatiroidismo, ecc.). I composti che si accumulano prima di un blocco metabolico spesso diventano tossici a causa della loro trasformazione in reazioni biochimiche di bypass. Con il deficit di fenilalanina idrossilasi, nel sangue e nei tessuti si accumula non solo la fenilalanina, ma anche il suo prodotto di transaminazione, l'acido fenilpiruvico, che ha un effetto tossico sul cervello di un bambino affetto da oligofrenia fenilpiruvica. Le enzimopatie della sintesi dell'urea portano all'accumulo di ammoniaca nel sangue e nei tessuti, accompagnato da danni tossici al sistema nervoso centrale.
Le enzimopatie possono essere associate a cambiamenti patologici nei recettori cellulari. Pertanto, la carenza ereditaria dei recettori di membrana delle lipoproteine a bassa densità porta ad una ridotta regolazione dell'attività degli enzimi di sintesi del colesterolo e all'ipercolesterolemia.
Alcune enzimopatie si manifestano con disturbi del trasporto attivo di membrana (ad esempio, trasporto di aminoacidi e cistina nella cistinuria, glucosio nella malattia da accumulo di glicogeno, acido glucuronico nell'iperbilirubinemia congenita).
Tipi di fermentopatie ereditarie:
Sulla base del principio dei principali disordini metabolici, le enzimopatie ereditarie sono suddivise nei seguenti tipi.enzimopatie del metabolismo degli aminoacidi (alcaptonuria, albinismo, ipervalinemia, istidinemia, omocistinuria, iperlisinemia, leucinosi, tirosinosi, fenilchetonuria, cistationinuria, cistinosi);
metabolismo dei carboidrati (galattosemia, glicogenosi, acidosi lattica, intolleranza al fruttosio);
metabolismo lipidico (lipidosi) - plasmatico (iperlipidemia ereditaria, ipercolesterolemia, deficit di lecitina-colesterolo aciltransferasi) e cellulare (gangliosidosi, mucolipidosi, sfingomielinosi, cerebrosidosi);
metabolismo delle purine e delle pirimidine (gotta, sindrome di Lesch-Nyhan, aciduria orotica);
biosintesi dei corticosteroidi (sindrome adrenogenitale, ipoaldosteronismo);
metabolismo della porfirina (porfiria) e della bilirubina) (vedi.
epatosi);
tessuto connettivo (sindrome di Marfan, sindrome di Ehlers-Danlos);
metabolismo dei metalli - distrofia epatocerebrale e malattia di Menkes (metabolismo del rame), emocromatosi (metabolismo del ferro), paralisi periodica familiare (metabolismo del potassio);
enzimopatie eritroniche - anemia emolitica, deficit di glucosio-6-fosfato deidrogenasi e glutatione reduttasi negli eritrociti, anemia di Fanconi (deficit di superossido dismutasi);
enzimopatie di linfociti e leucociti - stati di immunodeficienza con deficit di adenosina deaminasi, purina nucleotide fosforilasi, granulomatosi settica;
enzimopatie dei sistemi di trasporto renale (tubulopatia) - acidosi tubulare renale, malattia di de Toni-Debreu-Fanconi, diabete fosfato;
enzimopatie del tratto gastrointestinale - sindrome da malassorbimento con deficit di disaccaridasi, patologia del trasporto intestinale di glucosio e galattosio, diarrea congenita da cloruro.
Sintomi della fermentopatia ereditaria:
In base ai sintomi, le enzimopatie ereditarie possono essere suddivise in neuromuscolari (miopatie), endocrine, epatiche, metaboliche del connettivo, enzimopatie intestinali, eritrocitarie e leucocitarie, enzimopatie riparatrici del DNA (sindromi ad alto rischio di malattie maligne), enzimopatie lisosomiali.Riconoscere la fermentopatia dai segni clinici è molto difficile; lo stesso complesso di sintomi può essere causato da varie enzimopatie (ad esempio anemia emolitica, acidosi lattica, ipoglicemia, ritardo mentale, malattie simili al rachitismo). D'altra parte, le carenze in un sistema enzimatico possono portare a diverse manifestazioni cliniche. Pertanto, la carenza di fosfofruttochinasi è la causa di un tipo di malattia da accumulo di glicogeno, ma anche della lipomatosi. Esistono malattie ereditarie associate a difetti di molti enzimi (mucolipidosi II, la cosiddetta malattia delle cellule I).
Nonostante la significativa varietà di sintomi delle enzimopatie ereditarie, è possibile identificare segni generali che suggeriscono la presenza di una malattia metabolica in un bambino mediante un esame biochimico mirato. Questi segni includono: ritardo mentale, atetosi e atassia, sindrome convulsiva, stati comatosi ripetuti e sindrome di Reye, ricadute di chetoacidosi, odore specifico di urina o corpo (piedi sudati, urina di gatto, odore di topo, odore di malto o sciroppo d'acero), miopatie, anomalie, leucemia e trombocitopenia inspiegabili, immunodeficienza, alterazioni dei capelli e della pelle, cataratta, ingrossamento del fegato e della milza, sindrome da malassorbimento, morte inspiegabile di fratelli.
Enzimopatie nei bambini:
Molte enzimopatie compaiono già nel periodo neonatale, ma sono spesso interpretate dai medici come conseguenze di ipossia pre e postnatale, traumi intracranici alla nascita (vedi Trauma alla nascita dei neonati), distress respiratorio fetale. Una caratteristica distintiva delle enzimopatie ereditarie nei neonati è la presenza di un periodo asintomatico (2-3 giorni dopo la nascita). La condizione peggiora improvvisamente con manifestazioni di encefalopatia (sindrome da neurodistress). Varie anomalie metaboliche causate da molte enzimopatie raramente hanno caratteristiche specifiche, ma a seconda delle manifestazioni cliniche possono essere combinate in encefalopatie di tipo tossico e ipoenergetico.Le encefalopatie di tipo tossico sono associate all'accumulo di prodotti tossici prima del blocco enzimatico nella catena metabolica. Possono essere acidi organici (chetoacidi a catena ramificata di carbonio, acidi metilmalonico, propionico, isovalerico), ammoniaca, galattosio-1-fosfato e galattitolo, ecc.
Sintomi di fermentopatia nei bambini: rifiuto del seno, vomito, letargia e coma, convulsioni, arresto respiratorio e insufficienza epatica, ipertensione e clono muscolare, disidratazione, acidosi, chetosi, iperammoniemia.
Le encefalopatie di tipo ipoenergetico sono causate o dall'esaurimento dei substrati energetici oppure dall'incapacità di utilizzarli da parte dell'organismo a causa di un blocco enzimatico. Ciò si osserva nella fermentopatia della gluconeogenesi, glicolisi, ossidazione degli acidi grassi, deficit di deidrogenasi mitocondriale, quando si sviluppano gli stessi sintomi clinici delle encefalopatie tossiche (vomito, sonnolenza, coma), ma con grave ipotonia muscolare, iporeflessia, cardiomiopatia, insufficienza vascolare e collasso , morte improvvisa.
Di norma, la fermentopatia viene ereditata con modalità autosomica recessiva (ad eccezione di alcune forme di gotta, sindrome di Lesch-Nyhan, anemia emolitica da deficit di glucosio-6-fosfato deidrogenasi, mucopolisaccaridosi di tipo Gunther, ereditaria in associazione con sesso). Ciò non consente di ottenere le informazioni necessarie dall'analisi dei pedigree dei pazienti per due motivi: i genitori ei loro parenti, di regola, non presentano segni della malattia; il numero limitato di figli nelle famiglie moderne non consente di identificare casi di malattie simili nei fratelli.
Diagnosi di fermentopatia ereditaria:
Una diagnosi preclinica più affidabile viene effettuata utilizzando test di screening, che consentono l'attuazione di misure terapeutiche preventive (dieta, vitamine) prima dello sviluppo di manifestazioni gravi in malattie come fenilchetonuria, leucinosi, istidinemia, tirosinosi, galattosemia, sindrome adrenogenitale.Sono stati sviluppati metodi per la diagnosi prenatale delle enzimopatie ereditarie (diagnosi prenatale), che si basa sulla determinazione dell'attività degli enzimi nelle cellule coriali o nel liquido amniotico ottenuti durante l'amniocentesi alla 16a settimana di gravidanza. Per la diagnosi vengono utilizzate anche sonde gene-specifiche (molecole di DNA clonate o sequenze nucleotidiche sintetizzate corrispondenti alla struttura del gene) o metodi indiretti, se la struttura del gene per l'enzima corrispondente non è stata stabilita - studi sul polimorfismo della lunghezza di restrittori di DNA (frammenti) che presumibilmente includono questo gene o che confinano con le sue regioni (sequenze fiancheggianti).
Sono già stati sviluppati metodi diretti di diagnostica dell'ingegneria genetica per enzimopatie come la granulomatosi settica, la sindrome di Lesch-Nyhan, il deficit di ornitina transcarbamilasi, l'ittiosi legata al sesso e l'ipercolesterolemia familiare. I metodi indiretti vengono utilizzati per diagnosticare la fenilchetonuria, l'adrenoleucodistrofia e la sindrome adrenogenitale. I metodi per la diagnosi dell'ingegneria genetica delle enzimopatie coprono una gamma sempre più ampia di malattie e assumeranno un posto di primo piano nel prossimo futuro, sebbene non escludano la necessità di studiare l'attività enzimatica utilizzando metodi biochimici.
Trattamento della fermentopatia ereditaria:
Di primaria importanza nel trattamento delle enzimopatie ereditarie è la dietoterapia, che si basa sul principio di escludere dalla dieta i precursori dei prodotti tossici formatisi a seguito di un blocco metabolico. Sono stati proposti molti prodotti alimentari terapeutici da prescrivere immediatamente dopo il rilevamento della fermentopatia, compreso il passaggio a una dieta priva di latticini. La dietoterapia consente di mantenere un fenotipo normale, cioè di garantire uno sviluppo neuropsichico e fisico soddisfacente del bambino.Con la fermentopatia del sistema endocrino, è possibile ottenere un modellamento del fenotipo normativo prescrivendo farmaci ormonali appropriati. Alcuni F. possono essere trattati con alte dosi di vitamine (piridossina - per la sindrome di Comrover-Knapp, cistationinuria, omocistinuria; vitamina D - per il diabete fosfato, biotina - per deficit di carbossilasi, ecc.). La terapia della fermentopatia mediante la somministrazione di enzimi purificati di solito non ha successo a causa delle reazioni immunologiche dell'organismo alle proteine estranee somministrate per via parenterale. Alcuni effetti sono stati ottenuti dalla somministrazione parenterale di enzimi placentari purificati (ceramide triesosidasi nella malattia di Fabry, glucocerebrosidasi nella malattia di Gaucher) nelle forme lievi di patologia.
Un’alternativa è l’introduzione di cellule sane, il trapianto di midollo osseo o il trapianto di organi. L'uso di trapianti di fibroblasti sottocutanei per la mucopolisaccaridosi II ha portato ad una diminuzione dell'escrezione di mucopolisaccaridi, ma non ha influenzato le manifestazioni cliniche della malattia: il fenotipo patologico era già formato. Le trasfusioni di globuli rossi ripristinano l'attività dell'adenosina deaminasi in caso di immunodeficienza grave associata a deficit di questo enzima. Il trapianto di rene per la malattia di Fabry fornisce un miglioramento clinico e biochimico. I tentativi di migliorare i metodi di terapia enzimatica continuano. Per proteggere gli enzimi dall'inattivazione, si propone di racchiuderli in liposomi e somministrarli ai pazienti in questa forma. I liposomi che entrano nel flusso sanguigno vengono assorbiti dal fegato e dalla milza, quindi l'introduzione di enzimi nei liposomi è giustificata per le malattie da accumulo. I liposomi non penetrano la barriera ematoencefalica, quindi questa via di somministrazione degli enzimi non è efficace in caso di danno cerebrale.
Sono in corso sviluppi nel campo della terapia genica per la fermentopatia. Le sequenze nucleotidiche corrispondenti al gene dell'enzima mutante vengono introdotte utilizzando un vettore (retrovirus) nel genoma della coltura cellulare del paziente (leucociti, fibroblasti) e successivamente vengono reimpiantate in questo paziente. In particolare, sono stati proposti metodi per trapiantare l'adenosina saminasi e la superossido dismutasi sintetizzate.
Enzimopatie acquisite:
Le enzimopatie acquisite possono essere una conseguenza degli effetti tossici di xenobiotici e mutageni nell'ambiente esterno; sono responsabili di una varietà di manifestazioni della cosiddetta ecopatologia umana. I metalli pesanti (piombo, mercurio, ecc.), ampiamente distribuiti nell'ambiente esterno, hanno un effetto tossico su molti enzimi. Il piombo provoca un'inibizione persistente dell'enzima aminolevulinato deidrasi, che è coinvolto nella sintesi del porfobilinogeno e dell'eme, che si manifesta con lo sviluppo dell'anemia nei bambini urbani (la fonte del piombo sono i gas di scarico dei veicoli). I composti del mercurio sopprimono l'attività degli enzimi della respirazione tissutale legando i gruppi SH delle molecole. Come risultato dell'intossicazione, si sviluppa l'encefalopatia tossica (la "strana" malattia di Minamata). I radicali liberi dell'ossigeno, i perossidi e l'ozono, formati durante lo smog fotochimico nelle città, danneggiano l'enzima adenosina deaminasi dei linfociti: di conseguenza, i bambini sviluppano segni di immunodeficienza secondaria.Fattori mutageni e genotossici, incl. le radiazioni ionizzanti nell'ambiente causano mutazioni somatiche del gene dell'ipoxantina-gaunina-fosforibosil-transferasi. La patologia ereditaria di questo enzima è estremamente rara (sindrome di Lesch-Nyhan), mentre è comune la patologia acquisita. Tuttavia, quest'ultimo non si manifesta nei disturbi neuropsichiatrici, come nella sindrome di Lesch-Nyhan, ma in un aumento della concentrazione di acido urico nel sangue e nelle urine, nello sviluppo di immunodeficienza e nel rischio di malattie tumorali maligne. I pesticidi organofosforici (clorofos, metafos, ecc.) danneggiano selettivamente l'acetilcolinesterasi, che può portare a debolezza muscolare e distonia neurovegetativa. L'azione degli idrocarburi policiclici formati durante la combustione di combustibili solidi e liquidi (benzopireni, benzantraceni, ecc.) Si realizza attraverso il sistema delle monoossigenasi (citocromo ossidasi) e si manifesta come immunodeficienza parziale e tendenza delle cellule alla crescita maligna.
Negli ultimi anni sono diventate note le normali variazioni dell'attività degli enzimi coinvolti nell'inattivazione dei prodotti tossici, sia esogeni che formati durante il metabolismo. Queste variazioni vengono ereditate secondo le leggi di Mendel e determinano l'esistenza di fenotipi inattivatori veloci e lenti nella popolazione. Sono stati stabiliti per enzimi come l'aril idrocarburo idrossilasi (velocità di ossidazione degli idrocarburi policiclici), paraoxonasi (idrolisi dei pesticidi organofosforici), famiglia delle ossidasi del citocromo P-450 (sensibilità del corpo all'azione di molti farmaci), N- acetiltransferasi (acetilazione di alcuni xenobiotici), transferasi dell'acido glucuronico (glicosilazione di composti endogeni ed esogeni) e numerosi altri: tali varianti geneticamente determinate dell'attività enzimatica sono studiate dall'ecogenetica e dalla farmacogenetica umana.
Le enzimopatie nei bambini si formano anche durante la carenza di proteine, quando si verificano profondi disturbi nei processi anabolici o nell'assorbimento dei composti proteici (amminoacidi) dall'intestino in pazienti con indigestione cronica o patologie infettive del tratto gastrointestinale. La causa della fermentopatia può essere una carenza di biomicroelementi. Più di 180 enzimi nel corpo umano sono metalloproteine, cioè le molecole contengono ioni metallici. Il rame fa parte della ceruloplasmina (rame ossidasi), della lisil ossidasi, della tirosinasi, della citocromo ossidasi e di altri enzimi. Lo zinco è un elemento essenziale dell'anidrasi carbonica, della lattato deidrogenasi, della fosfatasi alcalina, dell'aldolasi e delle polimerasi degli acidi nucleici.
Molti enzimi contengono molecole di manganese, magnesio, molibdeno, cobalto e selenio. La carenza di biomicroelementi può essere causata dalle caratteristiche geochimiche dell'habitat, ma è più spesso associata ad un ridotto assorbimento o trasporto dei metalli. Ciò è stato identificato in enzimopatie come il deficit di ceruloplasmina (malattia di Menkes), il cofattore di molibdeno con deficit di ossido solfentato. Le enzimopatie, che si basano sulla carenza di proteine, sull'ipovitaminosi e sulla carenza di biomicroelementi, sono chiamate nutrizionali, pertanto i metodi di correzione dietetica sono di decisiva importanza nel loro trattamento.
Inviare il tuo buon lavoro nella knowledge base è semplice. Utilizza il modulo sottostante
Studenti, dottorandi, giovani scienziati che utilizzano la base di conoscenze nei loro studi e nel loro lavoro ti saranno molto grati.
postato su http://www.allbest.ru/
introduzione
I disturbi ereditari del metabolismo lipidico o lipoidosi (lipidosi) sono caratterizzati da un disturbo geneticamente determinato del metabolismo lipidico, in cui si verifica il loro accumulo intracellulare, che porta alla degenerazione grassa dei tessuti e degli organi. Queste includono: la malattia di Gaucher, la malattia di Niemann-Pick, l'idiozia amaurotica, la malattia di Gand-Schüller-Christian.Le lipidosi intracellulari colpiscono varie parti e sistemi del cervello e dei nervi periferici. Pertanto, è difficile attribuirli a malattie di qualsiasi sistema. Insieme a sintomi neurologici organici pronunciati, i pazienti sperimentano disturbi mentali significativi. Costituiscono quindi un gruppo di condizioni borderline tra le cliniche neurologiche e quelle psichiatriche. Le lipidosi intracellulari sono causate da difetti negli enzimi lisosomiali coinvolti nella scomposizione di composti cellulari ad alto peso molecolare, a causa dei quali alcune sostanze si accumulano all'interno dei lisosomi, il che alla fine porta alla morte cellulare. Nonostante la rarità di queste malattie e la breve aspettativa di vita dei pazienti, le lipidosi intracellulari sono state studiate più dettagliatamente dal punto di vista biochimico rispetto ad altre malattie ereditarie del sistema nervoso, grazie allo studio delle colture tissutali e del materiale bioptico. La composizione del tessuto cerebrale comprende sfingolipidi - derivati dell'amminoalcol insaturo sfingosina, acidi grassi e carboidrati. Il lipide più semplice è la ceramide, un composto di sfingosina con un acido grasso. Con la successiva combinazione di ceramide con glucosio, galattosio e altre sostanze, si formano lipidi più complessi: sfingomielina, galattocerebroside, glucocerebroside, ganglioside, ecc. La conversione di un lipide in un altro e nei prodotti successivi avviene con l'aiuto di enzimi appropriati. Un difetto nell'uno o nell'altro enzima porta all'accumulo del lipide corrispondente all'interno delle cellule, fenomeno chiamato lipidosi o sfingolipidosi.
1. Malattia di Gaucher
Si riferisce alle sfingolipidosi - malattie da accumulo di lipidi; è causata da un difetto nel gene responsabile della sintesi dell'enzima idrolitico lisosomiale beta-glucocerebrosidasi (beta-glicosidasi). Il difetto e la carenza di questo enzima portano ad un ridotto utilizzo dei lipidi - glucocerebrosidi e al loro accumulo nei macrofagi, principalmente nel midollo osseo, nella milza e nel fegato. Esistono tre tipi di malattia di Gaucher. Tipo 1 (benigno): non sono presenti disturbi neurologici, i cambiamenti viscerali sono associati principalmente ad organi emopoietici, ingrossamento della milza, ipersplenismo e distruzione del tessuto osseo. Negli altri due tipi non si è notata alcuna predominanza etnica. Il tipo 2 è una forma maligna del processo con gravi disturbi neurologici che si manifestano nei neonati e portano alla morte nei primi 2 anni di vita. Il tipo 3 è caratterizzato da variabilità nel danno viscerale e neurologico; nel suo decorso è meno maligno del tipo 2. La varietà delle forme della malattia di Gaucher è dovuta all'eterogeneità delle mutazioni nel gene della beta-glicosidasi.
Eziologia. La malattia di Gaucher è ereditata in modo recessivo; I figli di un genitore malato di solito non si ammalano. Tuttavia, ci sono casi di malattia tra nipoti, zie e zii. La mutazione genetica che porta alla malattia di Gaucher apparentemente ha contribuito alla selezione evolutiva degli individui con questo difetto, che ha determinato la prevalenza di questa mutazione in uno dei gruppi etnici.
Patogenesi. Accumulo di lipidi - glucocerebrosidi nei macrofagi; a causa della loro riproduzione, la milza e il fegato si ingrandiscono e la struttura delle ossa tubolari viene interrotta.
Quadro clinico. Inizialmente, ingrossamento asintomatico della milza, poi del fegato, dolore alle ossa. La citopenia aumenta gradualmente nel sangue. Le cellule di Gaucher sono presenti in abbondanza nel midollo osseo, nel fegato e nella milza.
Diagnosi stabilito mediante il rilevamento di specifiche cellule di Gaucher (nucleo simile a linfociti, situato eccentricamente e citoplasma chiaro molto ampio con striature circolari leggermente evidenti) nella puntura della milza (la puntura può essere eseguita solo in ospedale) o nel midollo osseo.
Trattamento forma maligna, sintomatica; nella forma benigna in caso di grave trombocitopenia, emorragie sottocutanee o significativo ingrossamento della milza - resezione della milza, splenectomia, trapianto di midollo osseo.
Previsione la forma maligna è grave: i bambini muoiono entro 1-2 anni; con la forma benigna, la maggior parte dei pazienti vive fino alla vecchiaia.
Prevenzione: in una famiglia in cui un bambino è già malato, è possibile diagnosticare un deficit di glucocerebrosidasi nelle cellule del liquido amniotico e si consiglia di interrompere la gravidanza.
2. ??????? ?????? - ???? (???)
Gruppo di malattie genetiche caratterizzate dall'accumulo di sfingomielina e colesterolo secondario negli organi interni. Nel 1961 Crocker, sulla base delle manifestazioni cliniche e biochimiche, identificò 4 tipi di BNP:
tipo A - BNP classico (manifesta in tenera età; tipiche sono le lesioni degli organi interni e del sistema nervoso centrale);
tipo B - caratterizzato da cambiamenti pronunciati negli organi interni dei neonati; Il sistema nervoso centrale non è coinvolto nel processo;
tipo C: danno lentamente progressivo al sistema nervoso;
tipo D - molto simile al tipo C, ma comune solo in Nuova Scozia (Canada).
Con i BNP di tipo A e B si riscontra un accumulo predominante di sfingomielina (causato dal deficit di sfingomielinasi), con i BNP di tipo C e D di colesterolo.
Il BNP di tipo C è una malattia autosomica recessiva caratterizzata da un'alterata esterificazione del colesterolo intracellulare. Allo stesso tempo, viene compromesso il suo trasporto nelle cellule, il che porta all'accumulo di colesterolo libero in vari tessuti del corpo. Il difetto genetico alla base della malattia è attualmente sconosciuto. Molto probabilmente è localizzato sul cromosoma 18q11.
Il BNP di tipo C è il tipo più comune della malattia; è la seconda causa più comune di malattia epatica geneticamente determinata nei bambini piccoli nel Regno Unito. Questo tipo ha una vasta gamma di manifestazioni cliniche. La malattia può manifestarsi in diversi periodi di età. È caratteristico l'ittero prolungato nei neonati, dopo la risoluzione della quale la malattia entra nello stadio latente. Le prime manifestazioni cliniche sono solitamente disturbi neurologici: distonia, atassia, disturbi del movimento verticale dei bulbi oculari, che compaiono più spesso all'età di 3 anni. Un declino delle capacità cognitive viene rilevato entro i 6 anni e progredisce successivamente. Successivamente, intorno agli 8 anni, si manifestano disturbi della deglutizione che portano a polmonite ab ingestis ricorrente. A poco a poco si sviluppa la completa immobilità dei pazienti. La malattia può manifestarsi inizialmente in età scolare con ridotta capacità di apprendimento o compromissione motoria. In generale, più tardi si manifesta la malattia, più lentamente si sviluppa.
Il principale substrato morfologico del BNP di tipo C sono gli istiociti schiumosi, presenti nel midollo osseo, nel fegato, nella milza e, meno comunemente, nella pelle e nei muscoli scheletrici. Le cellule gangliari del cervello si trasformano in elementi cellulari simili a palloncini notevolmente ingranditi. Il colesterolo libero nelle cellule viene rilevato mediante microscopia elettronica sotto forma di granuli osmiofili simili a membrane.
La diagnosi di LBP di tipo C può essere confermata definitivamente determinando il livello di esterificazione del colesterolo durante la coltura di fibroblasti cutanei con lipoproteine a bassa densità. Non esiste una chiara relazione tra il grado di disturbo dell’esterificazione e la gravità delle manifestazioni cliniche della malattia. Test simili che utilizzano la coltura dei villi coriali o le cellule amniotiche consentono la diagnosi prenatale. Esistono prove che indicano una diminuzione dell’accumulo di colesterolo libero durante una dieta ipocolesterolica, ma non sono abbastanza convincenti. Pertanto, questo approccio nei pazienti con LBP di tipo C non può attualmente essere raccomandato.
L'idiozia della malattia di Gaucher Niman
3. Idiozia ambrotica
Le malattie ereditarie del gruppo delle lipoidosi sono caratterizzate da crescente demenza, progressiva perdita della vista e convulsioni. Questo gruppo combina diverse forme di malattie simili nelle manifestazioni cliniche, ma differiscono nel momento di insorgenza della malattia, nella velocità di aumento dei sintomi e nel principale difetto biochimico.
Alcune forme della malattia compaiono durante l'infanzia (forma congenita Norman-Wood, forma Tay-Sachs della prima infanzia, forma Jansky-Bilschowsky della tarda infanzia); le altre sue forme compaiono più tardi (la forma giovanile di Spielmeyer - Vogt e la forma tarda di Kufs).
Il meccanismo principale per lo sviluppo dei disturbi neurologici è un disturbo geneticamente determinato del metabolismo dei lipidi nel tessuto cerebrale. L'idiozia amaurotica di Tay-Sachs è stata studiata nei minimi dettagli. La patologia è ereditata in modo autosomico recessivo, soprattutto spesso manifestata nei matrimoni consanguinei.
L'esame patomorfologico del cervello rivela cambiamenti specifici nelle cellule nervose. I neuroni sono pieni di una sostanza a grana fine simile al grasso. La loro morte si nota con la proliferazione del tessuto connettivo. Nelle fibre nervose si osserva la disintegrazione della sostanza bianca. Cambiamenti simili si riscontrano nella retina dell'occhio, soprattutto nell'area della macula. La sostanza simile al grasso si accumula anche negli organi interni e nei globuli rossi.
I primi segni della malattia compaiono all'età di quattro-sei mesi. Fino a questo periodo, il bambino si sviluppa normalmente: conosce bene i suoi cari, reagisce ai giocattoli, ride, mostra attività motoria. Perde gradualmente interesse per ciò che lo circonda. I bambini diventano letargici, privi di emozioni, smettono di giocare, di sorridere e di riconoscere i propri cari. Si osserva una perdita precoce della vista. Non c'è fissazione dello sguardo o tracciamento del giocattolo. Compaiono crisi convulsive, prevalentemente toniche o lievemente propulsive. Possono verificarsi convulsioni con forti stimoli sonori (convulsioni da iperacusia). La paresi centrale progredisce, di conseguenza il paziente è completamente immobilizzato. Si sviluppano i sintomi della paralisi pseudobulbare. Il decorso della malattia progredisce rapidamente e dopo uno o due anni porta alla morte dei pazienti.
La diagnosi della malattia di Tay-Sachs è confermata da un esame del sangue biochimico e da un'immagine del fondo. La retina presenta una caratteristica macchia rosso ciliegia (“nocciolo di ciliegia”) e atrofia del disco ottico.
Date le limitate opzioni terapeutiche per questa malattia, l’attenzione principale è rivolta alla sua prevenzione. Sono stati sviluppati metodi per identificare i portatori eterozigoti del gene patologico e metodi per diagnosticare l'idiozia amaurotica di Tay-Sachs nel feto.
Letteratura
1. Davydovsky I.V., Patologia umana generale, 2a ed., M., 2004.
2. Giornale medico russo, n. 4, 2007.
3. Anatomia patologica: libro di testo / A.I. Strukov, V.V. Serov. 5a edizione, cancellata. M.: Litterra, 2011. 848 pp.: ill.
4. MA Paltsev, N.M. Anichkov, M. G. Rybakova. Guida alle lezioni pratiche di anatomia patologica. M.: Medicina. 2002.
5. Paltsev M.A., Atlante di anatomia patologica. M.: Medicina. 2005
Pubblicato su Allbest.ru
...Documenti simili
Eziologia e quadro patologico della malattia di Pick. Sintomi e differenze dalla malattia di Alzheimer. Fasi di sviluppo della malattia. Procedure diagnostiche per valutare le condizioni del cervello. Trattamento farmacologico sintomatico della malattia di Pick.
presentazione, aggiunta il 30/03/2016
Definizione della malattia di Gaucher e sue principali caratteristiche. Studiare le cause di questa malattia. Quadro clinico e sintomi. Diagnosi differenziale. Studio delle metodiche di trattamento delle forme maligne e benigne della malattia di Gaucher.
abstract, aggiunto il 15/09/2014
Accumulo di lipidi nei lisosomi. Mutazione del gene che controlla la sintesi dell'enzima 7-d-glucocerebrosidasi. Funzione dei macrofagi compromessa. Principali tipi di malattia di Gaucher. Quadro clinico della tipologia non neuronopatica e della forma infantile neuronopatica.
presentazione, aggiunta il 03/08/2016
Il concetto di idrocefalo (acqua nel cervello). Caratteristiche delle sue forme congenite e acquisite, le ragioni principali del loro sviluppo. Patogenesi e quadro clinico della malattia. Segni di danno cerebrale organico, decorso e prognosi della malattia.
abstract, aggiunto il 29/03/2010
Malattia cronica progressiva del sistema nervoso centrale con distruzione e atrofia della corteccia cerebrale. Cause della malattia di Pick, patogenesi, alterazioni neuromorfologiche. Sintomi clinici e sinonimi della malattia. Diagnosi, trattamento, prognosi.
presentazione, aggiunta il 27/04/2017
Esame patoanatomico degli organi. Principali alterazioni metaboliche nella malattia di Niemann-Pick. Effetti collaterali dell'ipersplenismo. I primi sintomi clinici della malattia sono disturbi nel catabolismo della sfingomielina e il suo accumulo nelle cellule degli organi colpiti.
presentazione, aggiunta il 05/08/2017
Definizione del concetto ed essenza delle degenerazioni grasse. Considerazione della funzione dei lipidi nel corpo. Studio della lipidosi, dell'obesità e del deperimento. Quadro clinico della degenerazione grassa del cuore, del fegato e dei reni. Familiarizzazione con le manifestazioni delle malattie di Gaucher e Naman-Pick.
presentazione, aggiunta il 18/05/2014
Eziologia e patogenesi dell'ischemia cerebrale cronica. Lesioni diffuse bilaterali della sostanza bianca. Quadro clinico dell'ischemia cerebrale cronica. Segni oggettivi di danno cerebrale organico, prevenzione come compito principale degli operatori sanitari.
tesi, aggiunta il 26/01/2012
Malattie ereditarie associate a disturbi del metabolismo lipidico: malattia di Gaucher, malattia di Tay-Sachs, malattia di Niemann-Pick. Sintomi, decorso della malattia, metodi di diagnosi, trattamento e prevenzione. Aspetti genetici delle malattie. Previsioni per i malati.
abstract, aggiunto il 01/06/2015
Ascesso cerebrale - accumulo focale di pus nella sostanza del cervello, sua classificazione, eziopatogenesi. Meccanismo di contatto e diffusione ematogena. Quadro clinico e sintomi della malattia, metodi diagnostici, trattamento e prognosi.