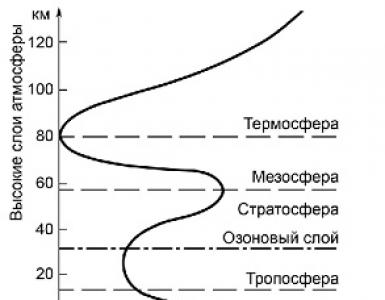
Metodi di diagnosi moderna dell'elmintiasi. Capitolo v. metodi di ricerca qualitativa. Studio degli ospiti intermedi di elminti
Molto spesso, l'infezione da elminti si verifica attraverso cibo, acqua e mani non lavate contaminati.
Metodi diretti e indiretti per la diagnosi dell'elmintiasi
Ad oggi sono stati sviluppati molti metodi diagnostica elmintiasi, ma tutti possono essere divisi in due grandi gruppi: diretto e indiretto. I metodi diagnostici diretti includono quegli studi che consentono di identificare direttamente gli elminti, i loro frammenti, larve o uova. I metodi indiretti per diagnosticare l'elmintiasi si basano sull'identificazione dei cambiamenti secondari caratteristici di un particolare tipo di elmintiasi.
I metodi diretti più popolari per diagnosticare le elmintiasi sono i metodi di ricerca macro e microelmintoscopici.
Metodi di ricerca macroelmintoscopica
Domande dei lettori
18 ottobre 2013, 17:25 Buon pomeriggio. È da quasi un anno che sento prurito intorno all'ano. Nessuno Dolore. Dimmi chi contattare e cosa potrebbe essere? Grazie
Fai una domandaMetodi di ricerca microelmintoscopica
Metodi di ricerca immunologica
La diagnosi di elmintiasi si basa sul rilevamento nel siero del sangue anticorpi specifici all'uno o all'altro elminto. Per ricerca immunologica vengono utilizzati il metodo di emoagglutinazione indiretta, il test immunoenzimatico, l'immunoelettroforesi, l'immunoassorbimento e altri metodi sierologici di analisi del sangue.
I metodi di ricerca immunologica vengono utilizzati per diagnosticare l'alveococcosi, l'echinococcosi, la cisticercosi, l'ascariasi, la schistosomiasi e altre elmintiasi.
Analisi del contenuto biliare e duodenale
Biopsia
Diagnostica dell'elettropuntura
La diagnostica dell'elettropuntura si basa sull'analisi della resistenza della pelle quando irritata da una debole corrente elettrica. La diagnostica dell'elettropuntura per sospetta elmintiasi può essere eseguita in due modi: utilizzando il metodo Voll o utilizzando il test di risonanza.
Metodi di ricerca strumentale
Viene eseguito anche per l'elmintiasi ecografia, FEDGS e diagnostica computerizzata. Questi metodi consentono di determinare l'entità del danno causato dagli elminti e di determinare le condizioni dei singoli organi.
Materiale per la ricerca: feci, urina, contenuto duodenale, espettorato, sangue, pelle, dendrite perianale, tessuto muscolare.
I metodi di ricerca microscopici si basano sul rilevamento di uova e larve di elminti. A seconda degli obiettivi dello studio, si dividono in qualitativi e quantitativi.
1. Metodo dello striscio spesso Kato. Il principio del metodo è che le uova di elminto vengono trovate in uno spesso strato di feci, schiarite con glicerina e colorate con verde malachite. Il metodo è più efficace contro l'ascariasi, la tricocefalosi, la difillobotriasi, la teniasi e, in misura minore, contro l'anchilostoma e la tenia nana.
3. Metodo di arricchimento(Kofoida - Barbera) si basa sul principio delle uova che galleggiano in una soluzione satura sale da tavola. Puoi trovare uova di trematodi, tenie, oncosfere, tenidi e uova di nematodi non fecondate.
4. Metodo Kalantaryan- il principio è lo stesso del precedente, ma come soluzione di flottazione viene utilizzata una soluzione satura di nitrato di azoto.
5. Ci sono metodi speciali esame delle feci per la presenza di fasciliasi, strongiloidosi, anchilostoma.
6. Metodo prianale e perianale-rettale diagnosi di enterobiasi. La raschiatura viene effettuata al mattino (prima di andare in bagno e prima di defecare) o la sera durante il sonno.
Molto importante da sapere
I protozoi si dividono in 4 classi:
Quando incistato, il microrganismo acquisisce forma arrotondata e ricoperto da un guscio protettivo. Sotto forma di cisti, i protozoi diventano meno suscettibili fattori sfavorevoli ambiente.
Potrebbero essere oggetto di ricerca:

Nota:Esistono molti tipi di diagnostica; considereremo quelli più comuni nella pratica clinica di laboratorio.
Tipi privati di diagnostica
In ogni caso specifico L'assistente di laboratorio ha il compito di trovare un agente patogeno specifico e talvolta ne vengono scoperti altri insieme a quello principale.
Esistono 6 specie di questo microrganismo capaci di vivere nell'intestino umano. Significato clinico Ne ha solo l'ameba dissenterica, che si presenta in forma vegetativa e sotto forma di cisti.

Inoltre applicare metodi immunologici:
- immunofluorescenza indiretta;
- agglutinazione indiretta (INA);
- immunodiffusione radiale.
Nota: i metodi sierologici non sono molto informativi e vengono utilizzati solo come aggiunta a quelli principali nei casi dubbi.
Diagnostica dei ciliati (ciliati)
La forma patogena dei microrganismi di questo genere è il balantidium. Questo è un microbo che causa la balantidiasi, una malattia accompagnata da un processo ulcerativo dell'intestino crasso. L'agente patogeno viene rilevato nello striscio nativo sotto forma di forma vegetativa e cisti. Il materiale per lo striscio (feci e muco) viene prelevato durante l'esame sigmoidoscopico e seminato su appositi terreni.
Diagnosi dei flagellati (Leishmania, Giardia, Tripanosomi, Trichomonas)
Leishmania, tripanosomi, lamblia e trichomonas sono pericolosi per l'uomo.
Leishmania– I microbi che causano la leishmaniosi vengono esaminati in strisci e materiali di sangue midollo osseo, raschiature da infiltrati cutanei. In alcuni casi, quando si diagnostica la leishmania, viene utilizzata la coltura su terreni nutritivi.
Tripanosomi– agenti patogeni malattia del sonno(Tripanosomiasi americana/africana o malattia di Chagas).
La variante africana viene determinata nel periodo iniziale durante lo studio sangue periferico. I microbi patologici man mano che la malattia progredisce si trovano nel materiale delle punture dei linfonodi, in fasi avanzate- nel liquido cerebrospinale.
Per diagnosticare i tripanosomi se si sospetta la malattia di Chagas, il materiale in esame viene esaminato al microscopio a basso ingrandimento. In questo caso, gli strisci e la goccia spessa sono precolorati.
Trichomonas(intestinali, orali) vengono rilevati al microscopio su materiali prelevati dalle mucose interessate.
Identificazione degli sporozoi (plasmodio malarico, agente eziologico della coccidosi, ecc.)
La specie più comune e pericolosa per l'uomo è il plasmodium malarico, che presenta 4 tipi principali di agenti patogeni: patogeno malaria terzana, malaria di quattro giorni, malaria tropicale e malaria ovale.
Lo sviluppo sessuale del Plasmodium (sporogonia) avviene nelle zanzare Anopheles. Asessuale (schizogonia dei tessuti e degli eritrociti) – in tessuto epatico ed eritrociti umani. Queste caratteristiche del ciclo di vita devono essere prese in considerazione durante la diagnosi plasmodio malarico.
Pertanto, nel sangue di un paziente appena malato, è possibile rilevare le cellule germinali del ciclo di sporogonia. Ma nel momento culminante degli attacchi malarici, gli schizonti compaiono in gran numero nel sangue. 
Inoltre, nelle diverse fasi della febbre malarica, varie forme plasmodio:
- durante il periodo freddo, il sangue si riempie di merozoiti, un tipo di schizonte;
- a temperature elevate, i trofozoiti a forma di anello si accumulano negli eritrociti;
- una diminuzione della temperatura è caratterizzata da una predominanza di trofozoiti simili all'ameba;
- durante i periodi condizione normale il sangue contiene forme adulte di schizonti.
Lo studio dell'agente eziologico della malaria (plasmodium malarico) viene effettuato in uno striscio e in una goccia spessa.
Nota:La diagnosi di malaria mediante esame di strisci e gocce di sangue spesse è talvolta errata. Le piastrine nel sangue in alcuni casi possono essere erroneamente attribuite all'agente patogeno della malaria. Anche qualche volta frammenti di leucociti e altre gabbie simulano il plasmodium.
Metodi di base per lo studio dei protozoi
Vediamo brevemente i metodi più comuni di ricerca della presenza di protozoi.
Diagnosi dei protozoi mediante striscio nativo e striscio colorato con soluzione di Lugol (nelle feci)
 Il farmaco viene preparato da un'emulsione di feci in una soluzione isotonica. Due gocce di cloro di sodio e la soluzione di Lugol vengono applicate su un vetrino. Il materiale di prova viene aggiunto ad entrambe le composizioni con un bastoncino di legno e, dopo aver coperto con vetro, viene osservato a diverse risoluzioni del microscopio.
Il farmaco viene preparato da un'emulsione di feci in una soluzione isotonica. Due gocce di cloro di sodio e la soluzione di Lugol vengono applicate su un vetrino. Il materiale di prova viene aggiunto ad entrambe le composizioni con un bastoncino di legno e, dopo aver coperto con vetro, viene osservato a diverse risoluzioni del microscopio.
I protozoi trovati vengono registrati in base a determinate caratteristiche. Per precisione, preparare 2-3 preparati dallo stesso materiale. Nei casi dubbi l'analisi viene ripetuta più volte nell'arco di 2-3 settimane.
Il metodo può rilevare forme vegetative e cistiche:
- lamblia;
- balantidio;
- ameba dissenterica.
Insieme alle forme patogene vengono identificati anche protozoi non patogeni. Anche nei portatori sani sono presenti forme luminali e cistiche.
Importante:la ricerca dovrebbe essere effettuata ripetutamente per evitare imprecisioni ed errori.
Il risultato della diagnosi dei protozoi utilizzando il metodo dello striscio nativo e colorato dovrebbe contenere una descrizione della forma dell'agente patogeno (luminale, cisti, tessuto).
Requisiti di ricerca:
- il materiale prelevato per l'analisi (feci liquide) viene esaminato entro e non oltre 30 minuti dalla defecazione;
- le feci formalizzate devono essere diagnosticate entro 2 ore dalla defecazione;
- il materiale non deve contenere impurità ( disinfettanti, acqua, urina);
- per lavorare il materiale utilizzare solo bastoncini di legno, quelli di vetro non sono adatti per lo scivolamento del muco;
- I bastoncini devono essere bruciati immediatamente dopo l'uso.
Metodo di conservazione (esame delle feci) per la diagnosi dei protozoi
Lo studio viene effettuato fissando i protozoi con un conservante. La differenza tra questo metodo e il precedente è che i conservanti permettono di conservare il farmaco per un lungo periodo.
Conservanti utilizzati:
- Carriola. Contiene ingredienti conservanti: 0,7 ml di cloruro di sodio, 5 ml di formalina, 12,5 ml di alcol al 96%, 2 g di fenolo e 100 ml di acqua distillata. Composizione colorante: soluzione allo 0,01% di tionina (azura).
- La soluzione di Safarliev. Ingredienti: 1,65 g di solfato di zinco, 10 ml di formalina, 2,5 g di fenolo cristallino, 5 ml di acido acetico, 0,2 g di blu di metilene, 100 ml di acqua. Questo conservante viene utilizzato nei casi in cui il materiale deve essere conservato per più di un mese.
Le bottiglie vuote vengono riempite con un conservante, il materiale viene trasferito al loro interno in un rapporto 3:1, quindi viene aggiunto colorante se necessario. I risultati vengono valutati studiando 2-3 farmaci.
Metodo di arricchimento con formalina-etere (analisi per la presenza di protozoi nelle feci)
Questo metodo diagnostico consente di separare e concentrare le cisti protozoarie. Per l'analisi sono necessari i seguenti ingredienti: formaldeide (10 ml), 0,85 g soluzione isotonica, acqua distillata, etere solforico, soluzione di Lugol.
La miscela di biomateriale con i liquidi elencati viene miscelata e centrifugata. Il sedimento ottenuto sul fondo della provetta viene colorato con la soluzione di Lugol ed esaminato per la presenza di cisti e forme vegetative.
Metodo per la rilevazione della Leishmania (striscio di midollo osseo)
Per diagnosticare la leishmaniosi vengono utilizzati i seguenti reagenti: miscela di Nikiforov (etere solforico e etanolo), tampone fosfato, Azur-eosina secondo Romanovsky.
La sostanza del midollo osseo viene posizionata con molta attenzione su un vetrino dopo una preparazione speciale. Viene utilizzato un microscopio con un sistema ad immersione.
 IN periodo acuto le malattie vengono rilevate nel punteggiato un gran numero di leishmania.
IN periodo acuto le malattie vengono rilevate nel punteggiato un gran numero di leishmania.
Nota:A volte cellule del sangue può somigliare alla Leishmania processata, quindi è molto importante che il tecnico di laboratorio stia attento e abbia sufficiente esperienza per condurre una ricerca indipendente.
Metodo per rilevare la leishmania in uno striscio di infiltrato cutaneo
I reagenti richiesti sono simili all'analisi precedente.
Il materiale di prova è ottenuto dal tubercolo esistente o dal contenuto ulceroso. Se si sospetta la leishmaniosi, il raschiamento viene effettuato con molta attenzione con un bisturi, senza sangue. Quindi la preparazione viene preparata su vetro. Per garantire l'accuratezza dei risultati ottenuti, vengono esaminati contemporaneamente più preparati.
Se c'è una malattia tra i macrofagi, i fibroblasti presenti nel materiale del test, cellule linfoidi Viene rilevata anche la leishmania.
Metodo per isolare una coltura pura di Leishmania ottenuta mediante raschiamento di tessuti patologici
Con questo metodo di diagnosi dei protozoi, i raschiati di tessuto vengono posti in uno speciale mezzo nutritivo in cui la Leishmania si moltiplica attivamente.
Prima di prendere la raschiatura, la pelle viene accuratamente trattata con alcool, quindi viene praticata un'incisione nel tubercolo, dal fondo del quale viene rimosso il contenuto e posto in una provetta con il mezzo. Il materiale viene prelevato più volte, dopodiché viene posto in diverse provette. Quindi la coltivazione avviene in un termostato ad una temperatura di 22-24 gradi. I risultati vengono valutati al microscopio. Questo metodo viene utilizzato quando altro, più economico e modi rapidi La diagnosi dei protozoi è inefficace.
Puoi vedere come vengono decifrati in pratica i test per la presenza di protozoi utilizzando una goccia di sangue guardando la recensione video:
Lotin Alexander, editorialista medico
DIAGNOSI DI LABORATORIO DELLE ELMINTOSI
La struttura dei segmenti della tenia viene studiata posizionandoli tra due vetrini. I segmenti della tenia bovina sono più grandi di quelli della tenia suina e della tenia larga; hanno più rami uterini laterali di quelli della tenia tenia di maiale, - circa 30 (contro 7-10) (Fig. 14, 15).


I segmenti della tenia larga sono corti, larghi e hanno una sporgenza a forma di rosetta al centro: l'utero (Fig. 16).

Solo i segmenti della tenia bovina sono mobili.
La testa di ciascun cestodo differisce in alcune caratteristiche. La testa della tenia del maiale è dotata di quattro ventose e di una proboscide con due file di uncini (tenia armata). Non ci sono uncini sulla testa della tenia bovina (tenia disarmata). La testa dell'ampia tenia ha due Bothria sui lati: fessure con l'aiuto delle quali l'ampia tenia è attaccata alla mucosa intestinale (Fig. 17, 18, 19).



Per identificare gli elminti, vengono esaminate le feci, il muco perianale e rettale, il contenuto duodenale, l'espettorato, il sangue e le particelle di tessuto. Importante negli studi microelmintologici viene utilizzata l'ovoscopia, che consente di fare una diagnosi basata sulla forma delle uova durante la microscopia dei preparati di feci e bile. Alcuni elminti sono localizzati al di fuori dell'intestino (cisticerco, trichinella, echinococco). In questi casi, per la diagnosi vengono utilizzati metodi di ricerca immunologica, biopsia, ecc.
Durante l'esame microscopico è necessario prelevare feci fresche o conservarle in una soluzione di formaldeide al 5% per evitare che le feci si secchino, modificando la forma delle uova e rendendo difficile una diagnosi corretta.
Vengono esaminati al microscopio su uno striscio nativo, dopo l'arricchimento - con il metodo di Fulleborn, Telemann, ecc.
Per preparare il farmaco nativo, una piccola parte di feci viene prelevata da diverse parti della porzione erogata e macinata accuratamente su un vetrino in una goccia di soluzione fisiologica di cloruro di sodio o di soluzione di glicerolo al 50%. La preparazione viene coperta con un vetrino coprioggetto e osservata al microscopio (almeno 2 preparazioni).
Metodo Shulman(farmaco nativo) presenta alcuni vantaggi. Usando questo metodo, puoi determinare le uova e le larve di alcuni elminti. Per fare ciò, 3 g di feci vengono immersi in un recipiente di vetro con acqua o soluzione fisiologica di cloruro di sodio (150 ml). Il contenuto del recipiente viene agitato con un'asta di vetro, a seguito della quale al centro, vicino all'asta, si forma una depressione a forma di imbuto. Il bastoncino viene rapidamente rimosso e la goccia di liquido rimasta in esso viene applicata su un vetrino, coperto con un vetrino coprioggetto ed esaminato al microscopio, identificando uova e larve di elminti.
Metodo di raschiatura utilizzato per la diagnosi di enterobiasi, taeniasi e taeniarincosi. Utilizzare un fiammifero affilato a forma di spatola, la cui estremità appuntita è inumidita in una soluzione di soda all'1%. Il contenuto della spatola viene trasferito su un vetrino in una goccia di soluzione di bicarbonato di sodio all'1%. La goccia viene coperta con un vetrino ed esaminata al microscopio.
Metodo Fulleborn consente di concentrare le uova di elminti per la ricerca e quindi aumenta la probabilità di rilevarle in questo modo. Preparare una soluzione di cloruro di sodio - 350 g per 1 litro d'acqua, scaldare a ebollizione e filtrare attraverso uno strato di cotone idrofilo o garza. In una tazza di porcellana da 100 ml vengono aggiunti 5-10 g di feci e diluiti gradualmente con una soluzione satura di cloruro di sodio. Qualsiasi fibra che galleggia in superficie viene immediatamente rimossa con carta da filtro. Il bicchiere con il suo contenuto viene lasciato in una cappa aspirante per 30 minuti -1 ora, sulla superficie si forma una pellicola in cui sono presenti uova di elminti che galleggiano in superficie. soluzione ipertonica. La pellicola viene rimossa con un filo o un'ansa di platino, applicata su un vetrino, coperta con un coprioggetto ed esaminata. Il metodo Fulleborn è utile per identificare le uova di tutti gli elminti rotondi, ad eccezione delle uova non fecondate dei nematodi e della tenia nana. Le uova di trematodi e grandi tenie galleggiano male, quindi è consigliabile osservare 2-4 preparati dal fondo della nave.
Accumulare le uova secondo il metodo Telemann sono necessari etere e acido cloridrico. In una provetta si versano 1-1,5 ml di etere e 5-6 ml di etere diluito di acido cloridrico, alla soluzione. aggiungere una piccola parte degli escrementi (1-2 g), agitare, filtrare con un colino spesso in una tazza di porcellana, versare in una provetta da centrifuga e centrifugare per 1 minuto. Nella provetta si formano tre strati: la parte superiore contiene grassi estratti, la parte centrale contiene acido cloridrico in cui si sono disciolte le sostanze proteiche e la parte inferiore contiene particelle non disciolte e uova di elminti. Si scolano i due strati superiori e dal sedimento si preparano 1-2 preparati che vengono esaminati al microscopio. Lo svantaggio del metodo è effetto dannoso acido cloridrico sul sistema ottico del microscopio e il suo effetto deformante sulle uova di elminti.
Secondo il metodo Kalantar 5 g di feci vengono mescolati in 10 volte il volume di una soluzione satura di nitrato di sodio. L'emulsione risultante viene filtrata attraverso una garza sottile. Dopo 10 minuti, dalla pellicola dalla superficie del liquido vengono preparati 5-6 preparati ed esaminati al microscopio.
Per l'opisthorchiasis, il metodo viene utilizzato per determinare l'intensità dell'invasione e l'efficacia della terapia. quantificazione uova nelle feci secondo Stoll. A tale scopo, in uno speciale pallone di vetro vengono versati 56 ml di soluzione decinormale di idrossido di sodio. Aggiungere 4 g di feci (fino ad un livello di liquido di 60 ml nel pallone) e agitare con sfere di vetro. Per lo studio, pipettare 0,075 ml (0,005 g) della miscela, trasferirla su un vetrino, coprire con un vetrino coprioggetto (22 x 23 mm) e contare il numero di uova (contenute in 0,075 cm3 della miscela) sotto un microscopio. Il numero risultante viene moltiplicato per 200, ottenendo il numero di uova in 1 g di feci. Sotto ci sono breve descrizione uova di elminti.
L'uovo fecondato del nematode è di forma ovale con uno spesso guscio multistrato. Il guscio proteico esterno è grossolanamente grumoso e di colore giallo scuro. All'interno dell'uovo c'è un blastomero sferico. Le dimensioni dell'uovo sono 50-70x40-50 micron. Uovo di nematode non fecondato di forma allungata, il guscio albume è sottile, finemente grumoso, di colore giallo. All'interno dell'uovo ci sono grandi cellule gialle poligonali. Dimensioni 50-100x40-50 micron. A volte le uova possono essere senza guscio proteico: trasparenti, incolori e ricoperte da un guscio uniforme e spesso (Fig. 20, 1, 2, 3).

Uova di tricocefali di forma ovale con uno spesso guscio multistrato di colore giallo dorato o marrone. Ai poli si trovano formazioni simili a sugheri. All'interno dell'uovo c'è un contenuto a grana fine. Dimensioni 50-54x22-23 micron (Fig. 20, 4).
Uova di ossiuri forma ovale irregolare con guscio multistrato sottile, liscio, incolore. Un lato è appiattito, l'altro è convesso. All'interno dell'uovo c'è un embrione vari gradi sviluppo fino alla larva. Dimensioni 50-60x20-30 micron (Fig. 20, 5).
Uova di anchilostomi forma ovale regolare con guscio sottile trasparente incolore. All'interno delle uova appena divise sono presenti 4 blastomeri. Dimensioni 54-70x36-40 micron (Fig. 20.6).
Uova di tenia bovina e suina struttura identica, forma sferica; guaina con 1-2 fili. All'interno dell'uovo c'è un'oncosfera (embrione) con uno spesso guscio striato radialmente Marrone scuro, con all'interno sei uncini embrionali. Le dimensioni dell'oncosfera sono 31x40 micron. Nelle feci umane non sono presenti uova, ma oncosfere (Fig. 20, 7).
Uova di tenia nana di forma ovale, hanno un sottile guscio incolore con all'interno un'oncosfera simile a un limone, dai poli della quale si estendono lunghe appendici filiformi (filamenti). Dimensioni 40x50 micron. Nell'oncosfera sono presenti 6 uncini germinali (Fig. 20.8).
Uova larghe di tenia di forma ovoidale con guscio grigio spesso e liscio. All'interno dell'uovo c'è un contenuto a grana grossa, sul polo superiore c'è un cappuccio, sul polo opposto c'è un tubercolo. Dimensioni 68-71x45 micron (Fig. 20, 9).
Uova di passera di gatto Hanno una conchiglia sottile, liscia, di colore giallo pallido con un opercolo sul polo superiore e una spina sul polo opposto. La metà inferiore dell'uovo è espansa, il contenuto interno dell'uovo è a grana fine. Dimensioni 26-32X11-15 micron.
Per rilevare le larve di anchilostoma e acne, viene utilizzato il metodo Berman. 5 g di feci su un colino metallico vengono posti sopra un imbuto di vetro fissato a un treppiede. Sul beccuccio dell'imbuto è posizionato un tubo di gomma con una fascetta. Nell'imbuto viene versata l'acqua riscaldata a 50° C Parte inferiore il colino con le feci era vicino all'acqua. Le larve si spostano attivamente dalle feci all'acqua, accumulandosi nella parte inferiore del tubo di gomma. Dopo 2 ore, aprire lentamente la pinza, scaricare l'acqua con le larve in provette da centrifuga, centrifugare e preparare i preparati dal sedimento su un vetrino, che vengono esaminati sotto un coprioggetto.
Per determinare le larve di Trichinella nel sangue, il sangue prelevato da una vena viene emolizzato con acqua distillata, centrifugato e dal sedimento vengono preparati preparati che vengono esaminati al microscopio.
Lo studio del contenuto duodenale si effettua come segue: la bile viene miscelata con un uguale volume di etere etilico e centrifugata; Il sedimento viene esaminato al microscopio. Oltre ai sedimenti, vengono esaminati i fiocchi galleggianti nel liquido, che possono contenere uova di elminti.
Per la cisticercosi e la trichinosi vengono esaminati anche i tessuti. Un pezzo di tessuto sottoposto a biopsia: muscolo tessuto sottocutaneo, pelle - esaminata prima ad occhio nudo per identificare una vescicola di cisticerco, la cui lunghezza è 6-20 mm, larghezza - 5-10 mm. Se si sospetta il cisticerco, la vescicola viene schiacciata tra due vetrini ed esaminata al microscopio. La cisticercosi è caratterizzata dalla presenza di uno scolice con quattro ventose e un cerchio di uncini.
Per rilevare la Trichinella, un pezzo di muscolo asportato asetticamente (gastrocnemio, ecc.) viene frantumato in una soluzione di glicerina al 50% in fibre sottili utilizzando aghi da dissezione. Queste fibre vengono schiacciate tra due vetrini ed esaminate al microscopio a basso ingrandimento in un campo visivo scuro. Le larve di Trichinella sono avvolte nei muscoli sotto forma di spirale e si trovano in capsule (Fig. 21).

Il metodo di esame a raggi X viene utilizzato per l'echinococcosi, la cieticercosi, la trichinosi (dopo la calcificazione delle larve) e l'ascariasi.
In alcuni casi vengono utilizzati metodi diagnostici immunologici.
Gli elminti, così come i loro prodotti metabolici, hanno proprietà antigeniche per il corpo umano. Come risultato della presenza di elminti nel corpo umano, si verificano cambiamenti allergici, che possono essere rilevati mediante speciali test allergici intradermici. Inoltre, nel corpo delle persone infette si formano vari anticorpi: precipitine che fissano il complemento. Le metodiche immunodiagnostiche acquistano particolare valore nei casi in cui l'ovoscopia non può essere utilizzata, in particolare con trichinosi, echinococcosi, cisticercosi, ascariasi in fase migratoria e con invasione di soli maschi.
Per l'echinococcosi e la trichinosi, viene eseguito un test di agglutinazione al lattice, un test di Kalus e per la cisticercosi, un test con un antigene preparato da Bobrov e Vozna. Per alcune elmintiasi è possibile utilizzare test sierologici: la reazione di precipitazione delle larve di ascaris con il siero sanguigno di un paziente nella fase migratoria dell'ascariasis, la reazione di precipitazione del siero sanguigno di un paziente affetto da trichinosi con un antigene delle larve di trichinella , RSC in echinococcosi, trichinosi, opistorchiasi, cisticercosi.
Campionamento e conservazione
Per la ricerca, le feci vengono prelevate da luoghi diversi in porzioni di 50 ge inviate al laboratorio in un contenitore pulito di vetro o plastica con un coperchio ermetico. Vengono esaminate le feci fresche (non più vecchie di un giorno) e in alcuni casi (quando si esegue il test per la strongiloidosi) immediatamente dopo la defecazione. Sono stati proposti alcuni conservanti fecali contenenti uova di elminti: soluzione di formalina al 4-10%, che deve essere riscaldata a una temperatura di 50-60° per impedire lo sviluppo di uova di anchilostomi; miscela 0,2% soluzione acquosa nitrato di sodio (1900 ml), soluzione di Lugol (5 g di iodio, 10 g ioduro di potassio, 250 ml di acqua), formalina (300 ml) e glicerina (25 ml), in cui vengono conservate le uova di elminto per 6-8 mesi; una miscela di glicerina (5 ml), formalina (5 ml) e acqua (100 ml); soluzioni di detersivi all'1-1,5% “Lotos”, “Extra”, “Barf”, “Tide”, ecc. (nel rapporto in peso tra feci e soluzione detergente 1: 5); una miscela di mertiolato 1: 1000 (200 ml), formalina (25 ml), glicerina (5 ml), acqua distillata (250 ml) con l'aggiunta di 0,6 ml di soluzione di Lugol (in ragione di 1 g di feci ogni 10 ml di miscela).
Per diagnosticare le elmintiasi vengono utilizzati metodi macro e microelmintoscopici per l'esame delle feci.
Studi di macroelmintoscopia
Metodo di liquidazione
Una porzione giornaliera di feci viene accuratamente mescolata con 5-10 volte la quantità di acqua, versata in cilindri di vetro alti (barattoli, secchi) e lasciata finché le particelle sospese non si sono completamente depositate. Lo strato torbido superiore viene accuratamente drenato e alla superficie viene aggiunta acqua pulita (ripetere più volte fino a quando l'acqua sopra il sedimento diventa limpida). Drenare strato superiore, trasferire il sedimento in una cuvetta o in una capsula Petri e osservarlo (su uno sfondo scuro) sotto una lente di ingrandimento o ad occhio nudo.
Metodo di screening
Le feci mescolate con acqua vengono poste sul vaglio superiore dell'apparecchio, costituito da un sistema di setacci con fori di diametro decrescente, l'apparecchio viene collegato alla rete idrica e, aprendo il rubinetto dell'acqua, si lava, e il liquido che scorre il liquido viene scaricato nella fogna. Grandi elminti rimangono sul vaglio superiore, mentre quelli più piccoli vengono trattenuti su quelli inferiori. I setacci vengono capovolti e, dopo aver lavato il contenuto in cuvette scure, vengono esaminati ad occhio nudo o sotto una lente d'ingrandimento.
Studi di microelmintoscopia
Effettuare allo scopo di rilevare le uova (metodi elminti-ovoscopici - colore. Fig. 1) o le larve di elminti (metodi elminti-ovoscopici).
Metodi elmintoovoscopici
Metodi qualitativi senza arricchimento
Striscio nativo. Una piccola quantità di feci viene macinata su un vetrino in una goccia di soluzione di glicerina al 50% o acqua bollita. Le particelle grandi vengono accuratamente rimosse, la miscela viene coperta con un coprioggetto ed esaminata al microscopio (vengono esaminati due strisci). È più comodo e più semplice preparare strisci lunghi tra due vetrini. Lo striscio nativo viene utilizzato solo in aggiunta ai metodi di arricchimento, poiché non è sufficientemente efficace, soprattutto per le infestazioni deboli.
Spessa macchia di cellophane secondo Kato(K. Kato, 1954) è un metodo di ricerca molto efficace. Pezzi di cellophane idrofilo (dimensioni 4x2 cm) vengono immersi per 24 ore in una miscela di glicerina (50 ml), soluzione di fenolo al 6% (500 ml) e soluzione acquosa al 3% (6 ml) di malachite verde (quest'ultima è facoltativa ). OK. 100 mg di feci vengono spalmati su un vetrino e coperti con un pezzo di cellophane umido, pressati con un tappo di gomma n. 5. Il preparato viene esaminato dopo 30-60 minuti, quando si asciuga leggermente e diventa limpido, come risultato del quale le uova di elminti sono facili da individuare al microscopio a basso ingrandimento.
Metodi qualitativi con arricchimento (metodi float e sedimentazione)
I primi si basano sull'uso di soluzioni sature di vari prodotti chimici. sostanze in cui galleggiano le uova a causa delle differenze di peso specifico.
Metodo Kofoid-Barber(Ch.A. Kofoid, M.A. Barber) modificato da Fulleborn (F. Fulleborn, 1920). OK. 5 g di feci in un barattolo alto e stretto (volume 100 ml) vengono mescolati con un bastoncino di legno in 100 ml di una soluzione satura di sale da cucina, sp. il suo peso è 1,18 (400 g di sale si sciolgono facendo bollire in 1 litro d'acqua). Galleggiò in superficie particelle di grandi dimensioni rimuovere rapidamente con un bastoncino o un pezzo di carta. Dopo aver sistemato la miscela per 45-90 minuti. Utilizzare un'ansa metallica (0,8-1 cm di diametro) per rimuovere tutta la pellicola superficiale e trasferirla su un vetrino. Quando si testano le uova di anchilostomi, la miscela viene lasciata riposare per 10-15 minuti. È possibile rimuovere la pellicola direttamente con un vetrino, coprire il barattolo in modo che venga a contatto con il liquido (ai bordi del barattolo viene aggiunta una soluzione salina satura). Dopo la sedimentazione, il vetrino viene rimosso, capovolto rapidamente e la pellicola con uova di elminti adese viene esaminata al microscopio (senza vetro di copertura). Questo metodo è efficace per identificare le uova di tutti i nematodi e delle tenie nane. Uova di trematodi pesanti; La maggior parte dei cestodi e dei nematodi non fecondati galleggiano male, quindi viene esaminato anche il sedimento. Per fare ciò, dopo aver rimosso la pellicola, si scarica rapidamente il liquido dal barattolo e si prelevano alcune gocce dal sedimento con un'ansa o una pipetta, si trasferiscono su un vetrino, si aggiunge una goccia di glicerolo per chiarificare ed si esamina sotto microscopio microscopio.
Metodo E.V. Kalantaryan(1938) È una modifica più efficace del metodo Fulleborn. In esso, la soluzione di sale da cucina viene sostituita da una soluzione satura di nitrato di sodio, sp. il peso è 1,39 (un volume di nitrato di sodio viene sciolto in un uguale volume di acqua quando viene bollito), la pellicola viene rimossa dopo 20-30 minuti.
Vengono utilizzati anche i metodi di Faust (E. S. Faust, 1939), Brudastova et al. (1970) e altri.
I prodotti chimici vengono utilizzati per depositare le uova di elminti. sostanze che dissolvono i grassi e le proteine nelle feci.
Metodo Telemann (W. Telemann, 1908) modificato da Miyagawa (Y. Miyagawa, 1913). OK. 5 g di feci vengono macinati in un mortaio o barattolo, aggiungendo 5 ml di etere etilico e soluzione salina al 50%; la miscela viene filtrata attraverso un setaccio metallico o per capelli in una provetta e centrifugata. Nella provetta si formano 3 strati: in alto - etere con grasso disciolto, in basso - acido cloridrico con sostanze proteiche disciolte, nel sedimento - parti insolubili di feci e uova di elminti. Gli strati superiori vengono drenati e l'acqua viene aggiunta al precipitato e centrifugata. Alcune gocce di sedimento vengono trasferite su un vetrino ed esaminate al microscopio. Questo metodo può rilevare le uova di tutti i tipi di elminti, ma a volte sono deformate.
Metodo Ritchie (L. S. Kitchie, 1948). La formaldeide e l'etere vengono utilizzati per sciogliere grassi e proteine.
Vari detergenti possono essere utilizzati per far precipitare le uova di elminti. All'estero si è diffuso il metodo di filtrazione in speciali dispositivi Bell, che viene utilizzato per studiare non solo le feci, ma anche l'urina, il sangue, ecc.
Esistono numerosi metodi che combinano i principi della flottazione e della sedimentazione delle uova. Questi includono i metodi di S. A. Lane, D. Rivas, Gorkina e S. T. Darling. Uno di questi metodi di flottazione-sedimentazione, così come il metodo dei drenaggi sequenziali, è stato proposto da N.V. Demidov (1963, 1965) per la ricerca sulla fascioliasi e sulla dicroceliosi.
Metodi quantitativi
Metodo Stoll(NR Stoll, 1926). Una soluzione decinormale di idrossido di sodio viene versata in una provetta larga o in un pallone graduato (con due tacche: 56 e 60 ml) fino alla prima tacca, si aggiungono le feci fino a quando il livello del liquido raggiunge la seconda tacca, si mescola accuratamente con una bacchetta di vetro e , posizionando 10 perle di vetro o piccoli sassolini, tappare e agitare per 1 minuto. Rapidamente, affinché la sospensione non si depositi, prelevare con una pipetta graduata 0,075 ml della miscela (0,005 g di feci), trasferirla su un vetrino su cui è applicata una griglia, coprire con un coprioggetto e contare le uova di elminti nella preparazione al microscopio; Moltiplicando il numero risultante per 200, si ottiene il numero di uova in 1 g di feci. Per più risultato esatto contare le uova in due o più preparazioni e prendere media. Il metodo Stoll è insensibile alle invasioni lievi. Pertanto, si consiglia di contare il numero di uova nelle preparazioni preparate con vari metodi di flottazione o sedimentazione, a condizione che venga costantemente utilizzata una porzione uguale di feci e piatti dello stesso volume. Viene utilizzato anche uno spesso striscio di Kato.
Metodo del castoro(RS Castoro, 1950). Viene preparato uno striscio standard, il cui spessore viene determinato utilizzando un elettrofotometro, quindi vengono contate tutte le uova di elminti in esso contenute.
Metodi elmintolarvoscopici
Metodo Behrmann(G.Baermann, 1917). 5-10 g di feci appena espulse vengono posti su una rete metallica in un imbuto di vetro, con un tubo di gomma con un morsetto all'estremità stretta. Per evitare la contaminazione del sedimento con particelle di feci, si consiglia di posizionare della carta (sulla rete) o aggiungere alle feci carbone animale o farina di mais. L'imbuto viene riempito con acqua tiepida (t° 45-50°) fino al contatto con le feci. A causa del termotropismo, le larve si muovono attivamente acqua calda e si accumulano gradualmente nella parte inferiore dell'imbuto, sopra la fascetta. Dopo 3-4 ore, la pinza viene aperta, il liquido viene drenato in 1-2 provette, centrifugato per 2-3 minuti, lo strato superiore viene drenato e il sedimento viene esaminato su un vetrino al microscopio.
Metodo per identificare i miracidi dello schistosoma. Le feci vengono lavate al buio ad una temperatura di 8-10°, il sedimento viene conservato per 45 minuti. in piena luce a t° 28°, quindi versare in un fiasco scuro con una cannuccia a lato. I miracidi sono concentrati in un tubo laterale trasparente, da dove possono essere selezionati.
Per identificare le larve degli anchilostomi vengono utilizzati anche i metodi di Fulleborn et al.
Metodi per studiare altre secrezioni, nonché tessuti e organi
OK. 100 ml di urina da analizzare vengono lasciati riposare per 30 minuti. in un cilindro e, dopo aver eliminato lo strato superiore, versare in una provetta 10-15 ml di sedimento, centrifugare a 1500 giri/min per 1-2 minuti; si esamina il sedimento. Si consiglia di raccogliere l'intera porzione giornaliera di urina.
La schistosomiasi urogenitale viene diagnosticata identificando i miracidi. Una porzione di urina fresca viene centrifugata per 5 minuti, il sedimento viene versato in un pallone verniciato di nero, con un tubo di vetro trasparente saldato alla sommità. Aggiungere acqua in rapporto 1:5, 1:10 e porre in termostato a 25-30° per 2 ore. I miracidi che emergono dalle uova sono visibili ad occhio nudo attraverso un tubo trasparente sotto forma di punti in rapido movimento. Nella cronica, una forma di schistosomiasi, i pazienti rilasciano sangue verso la fine della minzione, ma raramente si trovano uova nelle urine, per cui si consiglia di ricorrere a una biopsia della vescica.
Esame dell'espettorato. L'espettorato può contenere uova di paragonimus, schistosomi, tominx, larve di nematodi migratori e frammenti di vescica echinococcica. L'intera porzione di espettorato erogata viene attentamente esaminata ad occhio nudo o sotto una lente d'ingrandimento, vengono selezionati ed esaminati tutti i frammenti visibili di tessuto, accumuli color ruggine, ecc.; quindi scansionare l'intera porzione con strisci. L'espettorato purulento viene versato con una quantità uguale di soluzione alcalina caustica allo 0,5%, centrifugato e il sedimento esaminato.
In alcune elmintiasi si osserva espettorato cambiamenti caratteristici. Nella paragonimiasi, ad esempio, nell'espettorato si possono trovare accumuli di uova sotto forma di grumi giallastri, oltre a una grande quantità di muco, leucociti, globuli rossi, cellule alveolari, spirali di Kurschmann, fibre elastiche, cristalli di Charcot-Leyden . Sono stati rivelati anche i caratteristici cristalli a forma di diamante con estremità appuntite. La presenza di un gran numero di eosinofili consente di differenziare la paragonimiasi dalla tubercolosi.
Esame del contenuto di ascessi e punti puntiformi. IN secrezione purulenta ascessi, così come nei tumori e nelle cisti rimossi durante Intervento chirurgico, si possono individuare elminti, loro frammenti, larve e uova (echinococco, alveococco, sparganum, cisticerco, dirofilaria, nematodi, toxocara, paragonimus, ecc.). La tecnica di ricerca è consueta; in alcuni casi, vengono preparate sezioni istologiche dal tessuto tumorale. I contenuti purulenti possono essere trattati utilizzando il metodo Telemann; liquido chiaro Si esaminano allo stesso modo dei contenuti duodenali, aggiungendo etere solforico. Il liquido echinococcico viene centrifugato e il sedimento viene esaminato per la presenza di scolice e uncini; I preparati vengono colorati con carbolfuchsina secondo Ziehl-Neelsen.
Analisi del sangue. Nel sangue si trovano microfilarie e larve di nematodi migranti. Una goccia di sangue viene prelevata da un dito o dal lobo dell'orecchio ed esaminata fresco o preparare preparativi da esso.
Una goccia di sangue viene posta su un vetrino su cui viene applicato un quadrato di vaselina e pressato leggermente con un vetrino coprioggetto. Al microscopio sono visibili le microfilarie che si muovono tra le cellule del sangue. Il sangue può essere posto tra due strati di nastro adesivo di cellulosa; le microfilarie rimangono mobili per 6 ore; in un preparato completamente essiccato si possono distinguere al microscopio entro 30 giorni. Le specie Microfilarie possono essere identificate solo su strisci colorati o gocce spesse. Le preparazioni preparate vengono essiccate, emolizzate e colorate secondo Romanovsky - Giemsa, Wright, Ziehl-Neelsen, Leishman, Papanicolaou (vedi metodo di colorazione Wright, metodo Romanovsky-Giemsa, metodo Ziehl-Neelsen). Dopo aver rilevato le microfilarie in una goccia di sangue colorata secondo Romanovsky-Giemsa, il preparato viene ulteriormente colorato con ematossilina di Hansen; in 15-60 minuti. lavare per 2 minuti. nell'acqua corrente. Il preparato ricolorato è differenziato in soluzione fisiologica allo 0,2%; La guaina della microfilaria è dipinta di viola pallido e la sostanza nucleare del corpo è viola scuro.
Per le infestazioni lievi, è necessario esaminare 2-10 campioni di sangue con un anticoagulante (ad esempio, soluzione di citrato di sodio al 5%) utilizzando uno dei seguenti metodi.
Metodo di Knott (J. Knott, 1939), modificato da Markell e Voge (E.K. Markell, M. Voge, 1965). 2 ml di sangue vengono miscelati in una provetta da centrifuga con 10 parti di acido acetico all'1%, centrifugati per 2 minuti. a 1500 giri/min; si drena lo strato superficiale, si distribuisce il sedimento su più vetrini ed si esamina al microscopio. I preparati possono essere colorati utilizzando Romanovsky-Giemsa o altri metodi.
Metodo di filtraggio Bell (D. R. Bell, 1967). In un apparecchio costituito da un imbuto di acciaio inossidabile con foro rettangolare e filtri a membrana della stessa forma, di 19 x 42 mm, con una dimensione dei pori compresa tra 0,8 e 5 μm, sangue emolizzato in una miscela di 1 ml di detergente tipol e 9 ml di soluzione fiziol (per velocizzare la filtrazione il dispositivo è collegato ad una pompa a vuoto). Il filtro viene fissato in acqua distillata bollente e colorato con ematossilina calda di Romanovsky-Giemsa o Ehrlich. Il filtro colorato viene essiccato in un essiccatore o in alcool isopropilico (in sequenza in 3 tazze), chiarificato su vetro con olio da immersione ed esaminato sotto un coprioggetto. Le preparazioni colorate durano diverse settimane. Il metodo Bell è più efficace per la registrazione quantitativa delle microfilarie nel sangue.
Viene utilizzato anche il metodo del polividone Goldsmid.
Esame della pelle. Nella pelle si possono trovare microfilarie di onchocerci e larve di elminti animali che causano forma cutanea larva migrante(cm.). Si prelevano sezioni di pelle o materiale ottenuto mediante scarificazione nella zona della coscia, del polpaccio, dei glutei o a livello muscolo deltoide. Un pezzo di epidermide a forma di cono viene sollevato con uno spillo entomologico e, tagliato con un rasoio, esaminato su vetro in una goccia di soluzione fisiologica. Se il risultato è negativo, il campione fresco viene riesaminato dopo 10 minuti; Le larve sono solitamente localizzate ai bordi del preparato. Il materiale risultante può essere conservato in 2 ml di soluzione di fiziol per 1-2 ore. ed esaminare il sedimento. Si consiglia di prelevare 5 sezioni di pelle dal paziente.
I preparati possono anche essere preparati dal sangue e dal fluido tissutale rilasciati successivamente forte compressione fette Le gocce vengono colorate con l'ematossilina di Mayer, Romanovsky-Giemsa o Delafield.
Metodo standard per quantificare le infestazioni. Area cutanea sottoposta a biopsia diam. 3-5 mm e del peso di almeno 1-4 mg, pesare, tagliare a pezzetti e contare le larve al microscopio in fisiolo. soluzione su vetrino; 1-4 larve nel campo visivo sono indicate con un segno +, 5-9 larve con un segno ++, 10-19 con un segno +++, 20 o più con un segno + + + +. È più conveniente effettuare calcoli quantitativi su preparati colorati.
Test per trichinosi, cisticercosi e schistosomiasi
Individuazione delle larve di Trichinella
Metodo di compressione. Un pezzo di doppia testa o muscolo del polpaccio(vicino al tendine), preso chirurgicamente osservando l'asepsi, dividere con aghi da dissezione in fibre sottili separate, spremerle tra due vetrini in una goccia di glicerina in modo che il preparato sia sottile e trasparente. Al microscopio con campo visivo scuro, le larve di Trichinella sono chiaramente visibili. È efficace studiare diversi pezzi di muscolo nei compressori utilizzati in medicina veterinaria. pratica, soprattutto in trichinelloscopi speciali.
Metodo di digestione di Bechman(GW Bachman, 1928). 1 e i muscoli schiacciati vengono versati con 60 ml di artificiale succo gastrico(0,5 g di pepsina; 0,7 ml di acido cloridrico concentrato; 100 ml di acqua) e incubati per 18 ore. in termostato a t° 37°; si scola lo strato superiore di liquido, al sedimento si aggiunge acqua calda (t° 37-45°) e si versa in un apparecchio Behrmann. Dopo un'ora, il liquido viene scaricato in una provetta, centrifugato e il sedimento esaminato. Se le larve sono racchiuse in capsule calcificate, vengono prima decalcificate in una soluzione di acido cloridrico, azoto o solforico.
Saggio biologico. Pezzi dei muscoli studiati vengono somministrati a topi o ratti bianchi. Dopo 2-3 giorni, nel contenuto duodenale si possono trovare Trichine sessualmente mature e dopo 2-3 settimane si possono trovare larve nei muscoli del diaframma e della lingua.
Sezioni istologiche. Pezzi di muscolo vengono fissati in Bouin, Zenker o altro liquido; Le sezioni vengono preparate utilizzando un microtomo nel modo consueto e colorate con ematossilina di Delafield.
Rilevazione di cisticerchi
Un pezzo di muscolo estirpato, tessuto connettivo ecc. vengono esaminati ad occhio nudo, il cisticerco viene accuratamente isolato: una vescicola biancastra traslucida di 1-2 cm di dimensione, schiacciata tra due vetrini in una goccia di glicerina ed esaminata al microscopio. Per determinare la vitalità dei cisticerchi isolati dai tessuti, questi vengono conservati in una soluzione biliare al 50% per fisiolo. soluzione in termostato a t° 37°; in 10-60 minuti. la testa del cisticerco vitale è rivolta verso l'esterno. I cisticerchi calcificati vengono preliminarmente decalcificati con una soluzione al 4% di acido nitrico per un'ora.
Rilevazione di uova di schistosomi
Nelle forme croniche di schistosomiasi, quando la formazione di granulomi impedisce il rilascio delle uova dai tessuti nel lume intestinale o tratto urinario, viene utilizzata una biopsia della mucosa rettale, che viene eseguita con un cucchiaio speciale utilizzando un proctoscopio, selezionando un'area con una lesione visibile. Il pezzo sottoposto a biopsia viene schiacciato tra due vetrini ed esaminato al microscopio. Se il risultato è negativo, i pezzi vengono chiarificati in una soluzione al 4% di alcali caustici e da essi viene preparato l'istolo. fette. Biopsia della mucosa digiuno prodotto per via orale e il materiale risultante viene esaminato utilizzando il metodo di compressione o histol e da esso vengono preparate sezioni. In alcuni casi di schistosomiasi genitourinaria, la diagnosi può essere posta solo sulla base della biopsia endovescicale. Nella forma epatolienale della schistosomiasi, biopsia con ago fegato; Dal materiale risultante, l'istolo e le sezioni vengono preparati ed esaminati al microscopio a fluorescenza. Il microscopio a fluorescenza con campo scuro viene utilizzato anche per esaminare il tessuto epatico alla ricerca di uova di schistosoma. Se l'apparato genitale femminile è affetto da schistosomi, le secrezioni vengono raccolte mediante uno speculum vaginale oppure si prelevano pezzi di mucosa della cervice con un cucchiaio affilato; il materiale risultante viene esaminato al microscopio su vetro in una goccia di soluzione di fiziol.
Test per enterobiasi e taeniasi
Raschiamento perianale (si consiglia di effettuarlo la sera, 1 - 1,5 ore dopo che il paziente è andato a letto, o la mattina prima di andare in bagno). Un fiammifero tagliato obliquamente e imbevuto in una goccia di liquido (fisiolo, soluzione, acqua bollita o soluzione al 2% di bicarbonato di sodio) applicato su un vetrino, farlo con attenzione? raschiando la mucosa dell'ano e le pieghe attorno ad esso (dal centro verso l'esterno). Il muco raccolto al termine della partita viene raschiato con il bordo di un vetrino coprioggetto in una goccia di liquido su un vetrino e, coperto con lo stesso vetrino coprioggetto, viene esaminato. Negli esami di massa, quando si effettuano raschiamenti negli istituti pediatrici o in altri istituti, il fiammifero usato viene posto in una goccia di liquido su un vetrino; dopo che la goccia si è asciugata, viene coperto con un altro vetrino e consegnato al laboratorio, avvolto in carta e fissata con un elastico. Per esaminare il muco rettale che usano dispositivo speciale- una provetta di Shakhmatov o Ziemann, con la quale si preleva il muco dal retto ed si esaminano gli strisci al microscopio.
Metodo del tampone di cotone. Ai pazienti viene consegnata una provetta con un batuffolo di cotone su un bastoncino di vetro o di legno da portare a casa; al mattino il paziente pulisce le pieghe perianali con un tampone inumidito acqua bollita e lo mette in una provetta con una piccola quantità di acqua. In laboratorio, i tamponi vengono sciacquati nella stessa provetta con una nuova porzione di acqua e il sedimento viene esaminato dopo la centrifugazione.
Metodo del cellophane di Hall (M. S. Hall, 1937). Un pezzo quadrato di cellophane è fissato con un elastico su un'asta di vetro. La raschiatura viene effettuata con cellophane asciutto e posta in una provetta. In laboratorio si stacca leggermente il cellophane dal bastoncino e, dopo averne tagliato la punta con le forbici, lo si raddrizza su un vetrino; inumidito con soluzione decinormale di idrossido di sodio, coperto con un coprioggetto ed esaminato al microscopio.
Metodo del nastro di cellulosa di Graham (S. F. Graham, 1941). Una striscia di nastro di cellulosa viene pressata con il lato adesivo sulle pieghe perianali del soggetto, quindi con lo stesso lato su un vetrino ed esaminata senza vetrino coprioggetto; Puoi aggiungere una goccia di toluene. V. V. Kaledin (1972) per questi scopi propose di utilizzare dischi di celluloide tagliati da pellicola radiografica lavata e inumiditi con glicerina; i dischi vengono esaminati su un vetrino in una goccia di colla ai silicati. Il metodo del nastro di cellulosa può essere utilizzato anche per esaminare la biancheria intima dei bambini.
Raschiamento subungueale. I bordi dell'unghia, del letto ungueale e degli spazi subungueali vengono inumiditi con una soluzione allo 0,5-1% di alcali caustici e puliti con tamponi di cotone umidi. I tamponi vengono posti in provette da centrifuga con la stessa soluzione, centrifugati e il sedimento esaminato.
Metodi per studiare gli oggetti ambiente per uova e larve di elminti (studi sanitari ed elmintologici)
La ricerca viene effettuata per determinare il grado di contaminazione degli oggetti con uova e larve di elminti ambiente esterno. I dati ottenuti vengono utilizzati per valutare la dignità. lo stato delle istituzioni e delle imprese e l'efficacia delle misure adottate per combattere l'elmintiasi.
Quando si studia il grado di contaminazione vari oggetti ambiente con uova e larve di elminti e valutando il loro ruolo nell'epidemiologia delle infezioni da elminti, è importante stabilire non solo il numero di uova trovate, ma anche la loro vitalità e invasività, che sono determinate: a) dall'aspetto, al microscopio; b) colorazione con coloranti vari, anche luminescenti; di norma le uova e le larve vive non vengono dipinte; c) coltivazione in condizioni ottimali fino alla fase invasiva; d) infezione di animali da laboratorio (biotest).
Studi sulle acque e sulle fognature. Per uno studio, utilizzare 10-25 litri di acqua (fiumi, mari, stagni, piscine, riserve idriche) e 1-2-5 litri di liquami.
Metodo 3. G. Vasilkova (1941). L'acqua o i liquami vengono filtrati attraverso ultrafiltri a membrana in un apparecchio Goldmann, costituito da un imbuto di vetro o metallo con filtri collegati tramite un ugello ad anello a un pallone Bunsen. Per accelerare il processo di filtraggio, connettersi al dispositivo Pompa a vuoto. Dopo la filtrazione le membrane filtranti vengono esaminate al microscopio, chiarificate con una soluzione di glicerolo al 50%; il sedimento accumulato viene ripulito ed esaminato separatamente sotto forma di strisci. Vengono utilizzati anche dispositivi di filtraggio di altri modelli.
Metodo di G. Sh. Gudzhabidze e G. A. Yudin (1963) per lo studio del fluido fognario. 1 litro di liquido viene lasciato per 2 ore in un cilindro Lisenko; il sedimento risultante (5-9 ml) viene trattato come nell'analisi del terreno (vedi sotto).
Metodo N. A. Romanenko (1967). A 1 litro di liquido di scarto posto in un cilindro di vetro con una capacità di 1200-1500 ml, aggiungere 0,4-0,6 g di solfato di alluminio o cloruro ferrico (ai fini della coagulazione, accelerando il processo di sedimentazione delle particelle sospese) e dopo 40 minuti. la miscela viene centrifugata per 3 minuti. a 1000 giri/min; lo strato superiore viene drenato e per sciogliere i fiocchi aggiungere 1-2 ml di una soluzione al 3% di acido cloridrico, quindi 150 ml di una soluzione satura di nitrato di sodio. Il sedimento viene esaminato come il terreno.
Ricerca sul suolo
Viene determinata la contaminazione del suolo con uova di elminti al fine di identificare i focolai di elmintiasi e valutare l'efficacia del lavoro sul loro miglioramento.
Metodo 3. G. Vasilkova e V. A. Gefter (1948). In provette (volume 100 ml) di acciaio inossidabile o ottone si mescolano 12,5 g di terreno con 20 ml di una soluzione al 5% di alcali caustici, aggiungendo 10 perle di vetro o piccoli ciottoli. Le provette vengono sigillate con tappi di gomma e agitate per 20 minuti. in un apparecchio agitatore o manualmente. Tolti i tappi, le provette vengono centrifugate per 3-5 minuti, si scarica il liquido superficiale, si aggiungono al sedimento 60-80 ml di una soluzione satura di nitrato di sodio e, dopo accurata miscelazione, si centrifuga nuovamente per 3-5 minuti. Questa pellicola superficiale con uova galleggianti viene rimossa toccando la superficie della miscela con un anello complesso (5-6 anelli collegati su un'asta comune) e trasferita in un bicchiere d'acqua; mescolare con la stessa soluzione, centrifugare; L'intera procedura viene ripetuta almeno 3 volte. Il contenuto della tazza in cui viene trasferito il film viene diluito con acqua e filtrato attraverso filtri a membrana, che vengono esaminati al microscopio in una goccia di glicerolo.
Il metodo 3. G. Vasilkova e V. A. Gefter, modificato da A. A. Namitokov (1961), differisce dal metodo principale in quanto invece di esaminare i preparati su film, viene utilizzata metà del contenuto della provetta (ogni volta aggiungendo una nuova porzione di soluzione satura di nitrato di sodio), filtrata ed esaminare i filtri.
N. A. Romanenko (1968) raccomanda di testare campioni di terreno e sedimenti per individuare le uova di elminti Acque reflue utilizzando l'apparato proposto da G. Sh. Gudzhabidze. 50 g di terreno vengono accuratamente miscelati per 1 minuto. in 150 ml di acqua in provette da centrifuga (capacità 250 ml) con apposite lame azionate da motore elettrico. La miscela viene centrifugata per 3 minuti. a 1000 giri/min, scaricare l'acqua e aggiungere 150 ml di soluzione satura di nitrato di sodio, mescolare e centrifugare nuovamente per 3 minuti. Le provette con i campioni vengono poste su un supporto, viene aggiunta la soluzione di nitrato di sodio fino alla formazione di un menisco convesso, coperto con vetrini (10 x 6 cm) e lasciato per 10-15 minuti, quindi i vetri vengono rimossi ed esaminati; la procedura viene ripetuta almeno 4 volte.
Ricerca sulle larve di elminti utilizzando il metodo di Behrmann (1917). Si mettono 200-400 g di terreno in una garza su una rete metallica (con fori di 1-2 mm di diametro) posta sul parte larga imbuto di vetro montato su treppiede. Un tubo di gomma con un morsetto viene teso sull'estremità stretta dell'imbuto. L'imbuto viene riempito con acqua tiepida (t° 50°) in modo che la parte inferiore della rete con il terreno venga a contatto con l'acqua. A causa del termotropismo, le larve strisciano attivamente nell'acqua calda e, depositandosi, si accumulano nella parte inferiore del tubo di gomma sopra il morsetto. Dopo 3-4 ore, 50 ml del contenuto vengono rilasciati dall'imbuto in una provetta, centrifugati e il sedimento esaminato.
Ricerca di verdure, frutta e bacche
Studiano principalmente verdure, bacche e frutta consumati senza trattamento termico. Metodo 3. G. Vasilkova (1948). 5-10 pezzi di verdura o frutta (ca. 0,5 kg) oppure 100-200 g di verdure (insalata, cipolle verdi) versare l'acqua in barattoli di vetro a collo largo con tappo macinato per diverse ore e agitare per 10-20 minuti. in un apparecchio agitatore o manualmente. L'acqua viene scaricata, gli oggetti studiati vengono risciacquati acqua pulita e tutta l'acqua di scarico viene filtrata in un apparecchio Goldmann; I filtri vengono esaminati purificandoli con glicerina. Si possono colorare i filtri con la soluzione di Lugol al 25% in glicerina; in questo caso le uova di elminto sono di colore marrone e si riconoscono facilmente tra i granelli di amido, colorati di blu. I sedimenti di grandi dimensioni vengono trattati come terreno.
Studio dei dilavamenti da oggetti domestici e dalle mani. Un pennello per colla (o un batuffolo di cotone avvolto in un pezzo di tessuto di nylon) imbevuto di una soluzione al 2% di bicarbonato di sodio viene passato ripetutamente sull'oggetto o sulle mani in esame, quindi risciacquato con la stessa soluzione versata in una provetta. In laboratorio pennelli e tamponi vengono risciacquati con acqua pulita; Tutta l'acqua di lavaggio viene centrifugata e il sedimento viene esaminato.
Metodo V. A. Gefter (1960). È più efficace raccogliere la polvere dalle apparecchiature morbide utilizzando un aspirapolvere collegato ad un imbuto; i bordi sono costituiti da 2 parti staccabili: sulla superficie della parte inferiore è posto un filtro a membrana, ricoperto da una rete metallica o plastica, e rinforzato indossandolo parte in alto imbuti. L'imbuto assemblato è collegato al tubo dell'aspirapolvere con un tubo di gomma. La polvere viene raccolta dall'oggetto per 3 minuti, dopodiché il filtro viene rimosso e sostituito con uno nuovo. In laboratorio i filtri vengono esaminati al microscopio, chiarificati con glicerina. Se lo strato di polvere sul filtro è consistente, viene raschiato via e visionato sotto forma di aloni o trattato come terra.
Metodi diagnostici immunologici
Possibilità di utilizzare immunol. I metodi per diagnosticare l'elmintiasi sono dovuti alla capacità degli elminti di produrre antigeni attivi che colpiscono le cellule immunocompetenti dell'ospite e stimolano la produzione di anticorpi. I metodi immunodiagnostici sono più efficaci per elmintiasi intestinali quando le secrezioni e gli escrementi degli elminti, dotati di attività antigenica, entrano direttamente nel sangue dell’ospite. Le reazioni immunologiche vengono utilizzate per la diagnosi di ascariasi, trichinosi, filariasi, schistosomiasi, echinococcosi e alveococcosi, cisticercosi, paragonimiasi, complesso sintomatologico della larva migrans (toxocariasi, angiostrongilosi), ecc. Vengono utilizzati vari test sierologici (reazioni di precipitazione, reazioni di agglutinazione, fissazione del complemento , anticorpi fluorescenti ) e intradermici test allergici. Gli antigeni vengono preparati da larve ed elminti maturi utilizzando estratti salini di omogenati di tessuti freschi congelati o liofilizzati, nonché vari liquidi biologicamente attivi (liquido da vesciche echinococciche, fluido della cavità nematodi, ecc.). A causa del fatto che gli elminti sono molto complessi struttura antigenica e nel loro mosaico antigenico ci sono componenti e determinanti individuali che reagiscono in modo crociato con altri tipi di elminti, batteri, antigeni ospiti, si stanno sviluppando metodi per purificarli da componenti non specifici. Si effettua il frazionamento metodi diversi: filtrazione su gel in colonne con Sephadex, cromatografia a scambio ionico su DEAE-Sephadex, trattamento con acidi, ecc. Gli antigeni frazionari hanno solitamente una specificità più elevata degli estratti interi, ma la loro attività è approssimativamente la stessa. I metodi immunodiagnostici sono sempre più utilizzati. Le reazioni vengono utilizzate non solo per l'identificazione più completa e precoce dei pazienti, ma anche per studiare i focolai e studiare l'epidemiologia delle elmintiasi.
Reazioni sierologiche. La reazione di microprecipitazione sulle larve vive viene utilizzata per diagnosticare i nematodi: la fase preimmaginale dell'ascariasi, della malattia degli anchilostomi e della trichinosi. La reazione diventa positiva 5-10 giorni dopo l'infezione (ascariasis, anchilostoma) e persiste per 90-100 giorni. L'antigene è costituito da larve di nematodi vive isolate dai tessuti di animali da laboratorio infettati sperimentalmente. Le larve isolate vengono accuratamente lavate dalle proteine ospiti con fisiolo sterile, soluzione e acqua distillata e 10-15 copie ciascuna. posizionati utilizzando una pipetta Pasteur su un vetrino sterile con pozzetto. Applicare 2-3 gocce del siero del test, coprire con un vetrino coprioggetto sterile, collocarlo in una camera umida (piastra Petri rivestita con carta da filtro inumidita) e lasciare agire per 24-48 ore. in termostato a t° 37°. A reazione positiva al microscopio a basso ingrandimento sono visibili intorno alla bocca e fori anali le larve sono masse bianco-grigiastre, leggermente opalescenti, di precipitati sferici o a forma di zigzag. L'efficienza della reazione raggiunge l'85-95%.
La reazione di precipitazione dell'anello è stata sviluppata da V.P. Pashuk (1957) per la diagnosi della trichinosi. La reazione diventa positiva a 2-3 settimane di malattia. La sua efficacia raggiunge l'80-90%. L'antigene è un estratto in polvere di larve essiccate a 35°, isolato dai muscoli di animali infetti. Nelle provette diam. 0,5 cm, versare 0,1 ml di ciascuna diluizione dell'antigene e adagiare con cura su di essa (o abbassarla sul fondo) una quantità uguale di siero in esame in modo che i liquidi non si mescolino. Le provette vengono conservate per 30 minuti. in termostato a t° 37°, e poi 30-60 minuti. a temperatura ambiente. Con una reazione positiva, all'interfaccia tra l'antigene e il siero appare un delicato anello biancastro, che si disintegra facilmente se agitato.
La reazione di precipitazione in gel secondo Ouchterlony (O. Ouchterlony, 1949) in micromodificazione di A. I. Gusev e V. S. Tsvetkov è stata proposta da I. A. Ginovker, E. A. Zabozlaeva, A. V. Doronin (1970) per la diagnostica fase iniziale opistorchiasi. Secondo i dati preliminari, la sua efficacia è dell’87%. L'antigene è un estratto di un omogenato di opisthorchis sessualmente maturo fresco congelato isolato dal fegato di gatti.
È stata sviluppata la reazione di emoagglutinazione indiretta (vedi) con diagnosticum, una sospensione di eritrociti di pecora formalinizzati e tanizzati, sensibilizzati con liquido echinococcico
L.N. Stepankovskaya (1972) per la diagnosi di echinococcosi e alveococcosi.
L'RNGA con un diagnosticum da eritrociti di pecora formalinizzati, sensibilizzati con un estratto di omogenato di cisticerchi freschi congelati di tenia di maiale, è stato proposto da L. M. Konovalova (1973) per la diagnosi di cisticercosi cerebrale; è efficace nell'85% dei casi.
L'RNGA con ascaris diagnosticum è proposto per diagnosticare la fase preimmaginale dell'ascariasis.
La reazione di fissazione del complemento (vedi) viene eseguita secondo il metodo abituale e viene utilizzata per la diagnosi di trichinosi e cisticercosi.
Metodo degli anticorpi luminescenti ( metodo indiretto). Questo metodo, con omogenato secco sgrassato di cisticerchi della tenia di maiale come antigene fissato su un vetrino, è stato sviluppato da JI. M. Konovalova (1973) per la diagnosi della cisticercosi umana. La stessa reazione con histol, sezioni di larve di Trichinella come antigene è stata sviluppata per la diagnosi di trichinosi.
E. S. Leikina, V. A. Gefter.