Caratteristiche anatomiche e fisiologiche del sistema ematopoietico nei bambini. anemia nei bambini. Caratteristiche anatomiche e fisiologiche del sistema sanguigno e linfatico
Il sangue, insieme alla linfa e al fluido tissutale, costituisce l'ambiente interno del corpo, fornendo condizioni ottimali per la sua vita. Il sangue è costituito da una fase liquida - plasma e elementi formati sospesi in esso - eritrociti, leucociti e piastrine (piastrine). Gli elementi formati occupano circa il 45% del volume sanguigno, il resto è plasma. La quantità totale di sangue nel corpo degli animali è pari al 6-8% del peso corporeo.
Il sangue si esibisce varie funzioni: trasporto, scambio gassoso, escretore, termoregolatore, protettivo ed umorale-endocrino. Grazie alla circolazione di vari elementi formati nel sangue, non viene mantenuta solo la comunicazione nervosa e ormonale, ma anche cellulare tra organi e tessuti.
Il sangue, insieme agli organi emopoietici, forma un sistema morfologicamente e funzionalmente complesso. Pertanto, la composizione del sangue periferico riflette innanzitutto lo stato degli organi emopoietici di cui è un derivato. Allo stesso tempo, questo sistema è strettamente connesso con l'intero corpo ed è sotto la complessa influenza regolatoria dei meccanismi umorali-endocrini e nervosi.
Dopo la nascita nei mammiferi, il midollo osseo diventa l'organo centrale dell'ematopoiesi. Delle cellule emopoietiche, gli eritrociti, i granulociti, i monociti e i megacariociti compaiono prima degli altri. Un po' più tardi si formano i linfociti (la loro formazione è strettamente correlata allo sviluppo del timo).
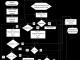
Secondo idea moderna riguardo all'ematopoiesi l'antenato di tutti gli elementi emopoietici è pluripotente cellula staminale, capace di automantenimento e differenziazione illimitati lungo tutti i germi emopoietici. Nei nuovi schemi ematopoietici tutte le cellule, a seconda del grado di differenziazione, sono combinate in sei classi (Fig. 42).
Classe 1: cellule staminali ancestrali, chiamate anche cellule progenitrici pluripotenti. Classe II: cellule pluripotenti parzialmente determinate con una capacità limitata di automantenimento. Possono differenziarsi solo nella direzione della mielopoiesi o della linfopoiesi. La mielopoiesi comprende tre linee: eritroide, granulocitica e megacariocitica. La linfopoiesi è rappresentata dalla formazione di linfociti T, linfociti B e plasmacellule. III classe- cellule progenitrici unipotenti. Sono in grado di differenziarsi solo in un certo tipo di cellula e sono estremamente limitati nell'automantenimento. Queste cellule esistono solo per 10-15 mitosi, dopodiché muoiono. Differenziazione; le cellule progenitrici unipotenti vengono effettuate sotto l'influenza dei regolatori ormonali dell'ematopoiesi - eritropoietina. leucopoietina, tromboietina, linfopoietine (attivine T e B). Per i linfociti, esistono due tipi di cellule progenitrici unipotenti: i linfociti T e B. I primi si differenziano nel timo e danno origine ai linfociti T, i secondi si differenziano nel midollo osseo nei mammiferi e nella borsa di Fabricius negli uccelli in linfociti B, che successivamente nella milza, nei linfonodi e in altre formazioni linfoidi si trasformano in plasma cellule che sintetizzano le immunoglobuline.
Le cellule delle prime tre classi sono morfologicamente irriconoscibili e non presentano caratteristiche morfologiche distintive stabili.
Dopo le cellule progenitrici unipotenti ci sono le altre tre classi. La classe IV comprende cellule proliferanti morfologicamente riconoscibili (eritroblasti, mieloblasti, megacarioblasti, monoblasti e linfoblasti, pronormociti, normociti basofili, promielociti e mielociti, promegacariociti, promonociti e prolinfociti). La classe V comprende cellule in maturazione che hanno perso la capacità di dividersi, ma non hanno raggiunto lo stadio di maturità morfofunzionale (normociti ossifili, metamielociti, leucociti a banda). La classe VI comprende le cellule mature presenti nel sangue periferico.
Le cellule delle ultime tre classi, tenendo conto della loro appartenenza ad uno specifico germe, sono caratterizzate da caratteristiche morfologiche e citochimiche specifiche.
Le osservazioni delle cellule del tessuto ematopoietico in coltura mostrano che le cellule mature e in maturazione sono incapaci di mitosi e proliferazione, ad eccezione dei linfociti. I linfociti mantengono il potenziale di divisione. È stato stabilito che i linfociti di origine timica (linfociti T) e midollo osseo (linfociti B) sotto l'influenza della stimolazione antigenica possono trasformarsi in forme blastiche, da cui successivamente si formano nuove forme di linfociti, e da forme blastiche di B -linfociti e plasmacellule.
La difesa cellulare e umorale dell'organismo è indissolubilmente legata al sistema emopoietico. Inoltre, se il tessuto emopoietico svolge la funzione di emopoiesi universale, allora il tessuto linfoide rilasciato nei mammiferi funziona come un sistema immunitario indipendente. La funzione principale del sistema immunitario è mantenere l'omeostasi genetica (costanza) delle cellule somatiche attraverso il riconoscimento, l'interazione e l'eliminazione dal corpo delle cellule mutanti e di altre sostanze ad esso estranee, che si presentano per via endogena o che entrano per via esogena.
Durante lo sviluppo di una risposta immunitaria, i linfociti T e B interagiscono tra loro e con altre cellule, principalmente con i macrofagi. Questi ultimi svolgono un ruolo importante nell'elaborazione dell'antigene e nella trasmissione delle informazioni ai linfociti immunocompetenti.
I linfociti T e B attivati formano cellule portatrici della memoria immunologica. La durata della vita di una popolazione di linfociti con memoria immunologica verso un antigene specifico determina la durata dell'immunità.
Allo stesso tempo, la resistenza del corpo non è determinata solo da specifiche reazioni immunitarie del sistema linfoide (LS). I sistemi di fagociti mononucleati (MPF), granulociti (SG), piastrine (PT) e complemento (SC), che svolgono un importante ruolo non specifico nello sviluppo e nell'attuazione delle reazioni immunitarie, prendono parte alla difesa dell'organismo.
Considerando la comunanza di molte funzioni e stretta connessione dei sistemi elencati, sono spesso combinati concetto generale- un sistema immunitario in cui il significato attivante e specifico appartiene al sistema linfoide, e tutti gli altri partecipano allo sviluppo e all'attuazione non specifici delle reazioni immunitarie del corpo.
La patologia del sistema sanguigno si manifesta molto spesso come sindromi anemiche ed emorragiche. A seconda della sindrome che guida, si distinguono due gruppi di malattie: anemia e diatesi emorragica.
ANEMIA
Anemia(Anemia) (anemia) è una condizione patologica caratterizzata da una diminuzione del contenuto di globuli rossi e di emoglobina per unità di volume di sangue. In caso di anemia è disturbato funzione respiratoria si sviluppa la carenza di sangue e ossigeno nei tessuti. Il bisogno di ossigeno è in una certa misura compensato da un aumento riflesso della respirazione, da un aumento della frequenza cardiaca, da un flusso sanguigno accelerato, da spasmi vasi periferici, il rilascio del sangue depositato, aumentando la permeabilità dei capillari e della membrana degli eritrociti ai gas. Allo stesso tempo, aumenta l'eritropoiesi.
Nonostante la varietà di ragioni, causando anemia, due processi principali occupano un posto di primo piano nella patogenesi: 1) perdita di globuli rossi ed emoglobina, superando le capacità rigenerative del germe eritroide midollo osseo; 2) formazione insufficiente di globuli rossi a causa di alterata emopoiesi del midollo osseo.
A seconda dello stato dell'ematopoiesi del midollo osseo, si distinguono tre tipi di anemia: rigenerativa, iporigenerativa e aregenerativa.
La classificazione accettata dell'anemia si basa principalmente sul principio eziopatogenetico. Secondo questa classificazione si distinguono i seguenti gruppi di anemia: 1) postemorragica - anemia dopo perdita di sangue; 2) emolitico - anemia dovuta alla maggiore distruzione dei globuli rossi; 3) anemia ipo e aplastica associata a disturbi emopoietici; 4) carenza di ferro e vitamine (alimentare) - anemia dovuta alla mancanza di ferro, vitamine B 12, C e acido folico. Sono più comuni negli animali giovani.
Anemia postemorragica (Anemia postemorragica) è una malattia che si verifica dopo la perdita di sangue e si manifesta con una diminuzione del contenuto di globuli rossi e di emoglobina nel sangue. Trovato in tutte le specie animali. La malattia è molto diffusa nell'allevamento di suini a causa del cannibalismo e nell'allevamento di animali da pelliccia a causa dell'autorosicchiamento. Si verifica in modo acuto e cronico.
Eziologia. L'anemia postemorragica acuta si verifica a causa di gravi emorragie esterne ed interne associate a danni ai grandi vasi sanguigni, soprattutto arteriosi. Può essere causato da varie lesioni. operazioni chirurgiche, ulcere perforanti dello stomaco e dell'intestino, rotture del proventricolo e dello stomaco durante timpano acuto, rotture dell'utero e della vagina durante il parto e altre patologie.Si osserva spesso negli animali che producono sieri immunitari dopo grandi salassi, così come con intensi diatesi emorragica.
L'anemia postemorragica cronica si sviluppa con sanguinamenti piccoli, prolungati o ripetuti associati a malattie renali, malattie della vescica, gastroenterite erosiva-ulcerativa; diatesi emorragica a lungo termine causata dalla mancanza di vitamine K e C nel corpo.
L'anemia postemorragica si osserva in alcune malattie infettive con sintomi di diatesi emorragica pronunciata (pasteurellosi, peste suina, anemia infettiva dei cavalli, ecc.), Così come nelle malattie invasive accompagnate da emorragia nascosta (ascariasis, paramphistomatidosi, dittocauulosi, ecc.).
Patogenesi. Con la perdita di un grande volume di sangue, si sviluppa un'ipossia acuta, manifestata da mancanza di respiro e tachicardia. Come risultato della caduta pressione sanguigna potrebbe verificarsi un collasso. La conta dei globuli rossi (emoglobina e globuli rossi) non cambia in modo significativo. Ciò è dovuto alla vasocostrizione riflessa e all'ingresso compensatorio del sangue depositato nel flusso sanguigno. Dopo 1-2 giorni inizia la fase idromica di compensazione. A causa dell'abbondante flusso di fluido tissutale nel flusso sanguigno, il contenuto di emoglobina e globuli rossi per unità di volume diminuisce rapidamente. L'indice di colore dei globuli rossi rimane vicino alla norma. A causa dell'aumento dell'ipossiemia e dell'aumento del contenuto di eritropoietina nel siero, l'ematopoiesi del midollo osseo aumenta, la formazione dei globuli rossi e il loro rilascio nel flusso sanguigno vengono accelerati. Pertanto, il 4-5o giorno, nel sangue compaiono in grandi quantità forme immature di eritrociti: policromatofili, eritrociti con punteggiatura basofila e reticolociti. L'anemia diventa ipocromica. Allo stesso tempo, nel sangue si osservano leucocitosi neutrofila e trombocitosi moderata.
Nel midollo osseo durante l'anemia postemorragica acuta si sviluppa un'iperplasia reattiva di tipo eritroblastico. Dopo periodo acuto l'emoglobinizzazione delle cellule eritroblastiche viene ripristinata e i globuli rossi con un normale contenuto di emoglobina entrano nel flusso sanguigno.
Nell'anemia cronica postemorragica, fino all'esaurimento delle riserve di ferro nell'organismo, a causa dell'aumento dell'eritropoiesi nel sangue, vicino al livello normale eritrociti con un contenuto di emoglobina leggermente ridotto. In casi prolungati, le riserve di ferro del corpo si esauriscono. La maturazione delle cellule eritroblastiche è ritardata. I globuli rossi leggermente emoglobinizzati entrano nel sangue. Si osserva anche leucopenia con relativa linfocitosi. Durante questo periodo, il quadro del sangue e del midollo osseo è lo stesso dell'anemia da carenza di ferro.
Nell'anemia postemorragica acuta si notano pallore di organi e tessuti, scarso riempimento dei vasi sanguigni, coaguli di sangue sciolti, iperplasia del midollo osseo, sostituzione del midollo osseo giallo con rosso e danni intravitali ai grandi vasi.
Negli animali morti per anemia postemorragica cronica, il sangue è acquoso e forma coaguli sciolti e gelatinosi. Si nota la degenerazione grassa nel fegato, nei reni e nel miocardio. Il midollo osseo è in uno stato di iperplasia e contiene molte cellule immature, soprattutto eritroblasti, pronormoblasti e normociti basofili. Negli animali giovani possono essere rilevati focolai di emopoiesi extramidollare nel fegato e nella milza.
Sintomi. I segni clinici dipendono in gran parte dalla durata del sanguinamento e dalla quantità di sangue perso. Perdere più di un terzo del sangue in breve tempo è pericoloso per la vita. In questo caso, l’emorragia esterna è più pericolosa dell’emorragia interna.
L'anemia postemorragica acuta è caratterizzata da segni di collasso e ipossia. Gli animali malati sviluppano sonnolenza e letargia, debolezza generale, instabilità durante il movimento, contrazioni fibrillare dei singoli gruppi muscolari e espansione dei crostacei. La temperatura corporea è bassa, la pelle è ricoperta di sudore freddo e appiccicoso. I maiali e i cani vomitano. La pelle e le mucose visibili diventano anemiche. Si sviluppano cadute di pressione arteriosa e venosa, mancanza di respiro e tachicardia. Il battito cardiaco batte forte, il primo tono si rafforza, il secondo si indebolisce. Il polso è frequente, piccole onde, riempimento debole. Allo stesso tempo si indebolisce funzione motoria gastrointestinale -tratto intestinale e la minzione diventa rara.
Nel primo giorno della malattia, nonostante la diminuzione del volume totale del sangue, il contenuto di emoglobina, eritrociti, leucociti e piastrine per unità di volume non cambia in modo significativo. Successivamente, il numero di globuli rossi e soprattutto di emoglobina nel sangue diminuisce. Gli eritrociti immaturi ipocromici si trovano in grandi quantità (fino al 30%): policromatofili, eritrociti con punteggiatura basofila e reticolociti (Fig. 43). Aumenta anche il contenuto dei leucociti, in particolare dei neutrofili e delle piastrine. La viscosità del sangue diminuisce e la VES aumenta.
A decorso cronico i segni di anemia aumentano gradualmente. Le mucose diventano pallide, progrediscono debolezza generale, affaticamento e sonnolenza. I pazienti si sdraiano di più, riducono la produttività e perdono peso. Presentano mancanza di respiro, tachicardia, suoni cardiaci indeboliti e comparsa di soffi endocardici funzionali. Il polso è frequente, filiforme, la temperatura corporea è bassa. Il gonfiore appare nel tessuto nell'area dello spazio intermascellare, dello sterno, dell'addome e degli arti.
A causa della carenza di ossigeno, sviluppo processi distrofici il normale funzionamento di molti sistemi viene interrotto. Nel sangue degli animali malati, il contenuto dei globuli rossi e soprattutto dell'emoglobina diminuisce, l'indicatore del colore diventa inferiore a uno. I globuli rossi hanno dimensioni e forme diverse e sono poveri di emoglobina. Anisocitosi, poichilocitosi e ipocromia sono uno dei segni caratteristici dell'anemia postemorragica cronica. Allo stesso tempo, una tendenza allo sviluppo della leucopenia con relativa linfocitosi, una diminuzione della viscosità del sangue e aumento della VES.
Diagnosi e diagnosi differenziale. L’anemia postemorragica acuta, causata da sanguinamento esterno, è facile da diagnosticare. Le difficoltà sorgono quando emorragia interna. In questi casi, insieme ai dati anamnestici, vengono presi in considerazione i sintomi della malattia e i risultati degli studi ematologici ( un forte calo livello di emoglobina, globuli rossi, aumento della VES), rilevamento di sangue nei punti puntiformi delle cavità, nelle feci e nelle urine. Quando si diagnostica l'anemia emorragica cronica, è importante identificare le fonti di perdita di sangue prolungata o ricorrente e tenere conto anche cambiamenti caratteristici nel sangue rosso - una diminuzione del numero totale di globuli rossi e in particolare di emoglobina, anisocitosi, poichilocitosi e ipocromia dei globuli rossi.
L'anemia postemorragica prolungata deve essere differenziata dall'anemia da carenza di ferro e vitamine. Cruciale ha una determinazione del livello del loro contenuto nei mangimi e nel corpo degli animali.
Previsione. Una rapida perdita di sangue pari a 1/3 del volume totale del sangue può portare allo shock e, nella maggior parte dei casi, la perdita di più della metà del sangue provoca la morte. La lenta perdita di sangue, anche di grandi volumi, con un trattamento tempestivo si conclude in modo sicuro.
Trattamento. Per l'anemia postemorragica, vengono adottate misure per arrestare il sanguinamento, reintegrare la perdita di sangue e stimolare l'ematopoiesi. I primi due principi sono particolarmente importanti per l'anemia postemorragica acuta, il terzo per quella cronica. Il sanguinamento esterno viene interrotto utilizzando metodi chirurgici standard. Inoltre, per fermare l'emorragia, in particolare l'emorragia interna, e con la diatesi emorragica, vengono somministrate per via endovenosa una soluzione al 10% di cloruro di calcio o gluconato di calcio, una soluzione di gelatina al 10% e una soluzione al 5% di acido ascorbico. Per ridurre e fermare il sanguinamento locale, viene spesso utilizzata una soluzione di adrenalina allo 0,1%.
Come mezzo terapia sostitutiva Il sangue, il plasma e il siero sanguigno stabilizzati di un singolo gruppo vengono somministrati per via endovenosa, indipendentemente dall'appartenenza al gruppo, alla velocità di 1-3 litri per animali di grandi dimensioni e 200-500 ml per animali di piccola taglia. Anche mostrato somministrazione endovenosa soluzione isotonica cloruro di sodio, soluzione Ringer-Locke, soluzione di glucosio con acido ascorbico, poliglucina e altri agenti sostitutivi del plasma. Soluzioni sostitutive del sangue e del plasma, soluzioni saline somministrato lentamente, non più di 1 litro per 5-10 minuti, in dosi di 5-10 ml/kg di peso animale.
Tra gli stimolanti emopoietici, i preparati di ferro sotto forma di glicerofosfato, lattato, solfato, carbonato, emostimulina, nonché i preparati di cobalto e rame vengono utilizzati internamente, stimolando l'assorbimento del ferro, la formazione dei suoi complessi proteici e l'inclusione nella sintesi dell'emoglobina.
Per migliorare l'assorbimento del ferro dal tratto gastrointestinale, all'animale viene fornito mangime contenente una quantità sufficiente di acido ascorbico, oppure vengono somministrate piccole dosi di questo farmaco in aggiunta. Per le malattie del tratto gastrointestinale, gli integratori di ferro vengono somministrati per via parenterale. A questo scopo è ampiamente utilizzata la ferroglucina, un farmaco DIF-Z contenente iodio ferro. Tra i preparati vitaminici come stimolanti dell'emopoiesi, insieme all'acido ascorbico, la vitamina B 12 viene somministrata per via parenterale e l'acido folico viene somministrato per via orale.
In caso di anemia postemorragica acuta, agli animali malati viene concesso riposo completo; in caso di anemia cronica, viene loro somministrato l'esercizio fisico necessario, tenuti in isolamento per evitare lesioni e ripresa di sanguinamento e forniti di una dieta nutriente. Gli onnivori e i carnivori traggono particolare beneficio dal fegato crudo.
Prevenzione. Vengono adottate misure per prevenire lesioni, identificazione tempestiva e trattamento di animali malati con emorragia acuta e cronica.
Anemia emolitica (Anemia emolitica) - un gruppo di malattie associate ad una maggiore distruzione del sangue, caratterizzata da una diminuzione del contenuto di emoglobina e globuli rossi nel sangue, comparsa di segni di ittero emolitico e, con intensa emolisi, emoglobinuria.
A seconda della causa dell'insorgenza, le anemie emolitiche sono divise in due gruppi: congenite (ereditarie) e acquisite. I primi sorgono come risultato di vari difetti genetici nei globuli rossi, che diventano funzionalmente difettosi e instabili. Le informazioni su questi tipi di anemia negli animali sono scarse.
Eziologia. Le anemie emolitiche congenite e geneticamente determinate sono associate a cambiamenti nella struttura delle lipoproteine nella membrana degli eritrociti, ridotta attività degli enzimi - glucosio-6-fosfato deidrogenasi, glutatione reduttasi, piruvato chinasi, nonché cambiamenti nella struttura e nella sintesi dell'emoglobina ( eredità dell'emoglobina S, alto contenuto emoglobina A 2 ed emoglobina fetale F).
Patogenesi. Nell'anemia emolitica, i globuli rossi vengono distrutti a seguito dell'emolisi intravascolare o intracellulare nei fagociti mononucleati. Nell'anemia causata da veleni emolitici e da iso- e alloanticorpi anti-eritrociti (malattia emolitica, trasfusione di sangue), si osserva prevalentemente emolisi intravascolare.
Il meccanismo di sviluppo della malattia emolitica negli animali neonati è che se le coppie genitoriali sono incompatibili con gli antigeni eritrocitari dominanti, gli antigeni fetali ricevuti dalla linea paterna possono causare l'immunizzazione della madre, accompagnata dalla formazione di anticorpi contro di essi. Tuttavia, poiché la placenta epiteliodesmocorionica degli animali da allevamento è impermeabile alle immunoglobuline, il trasferimento degli isoanticorpi antieritrociti è possibile solo attraverso il colostro. Pertanto, la malattia emolitica si manifesta il primo giorno dopo l'assunzione del colostro e raggiunge la sua massima gravità entro il 3-5° giorno di vita. Questa malattia si verifica spesso nei suinetti.
Indipendentemente dall'origine anemie emolitiche parallelamente alla distruzione dei globuli rossi, nel midollo osseo si sviluppa un'iperplasia reattiva del tessuto eritroide (Fig. 44). Il contenuto di forme immature di eritronociti bruscamente aumenta in esso. Aumenta il rilascio di policromatofili, reticolociti ed eritrociti nucleari nel sangue periferico. La durata della vita dei globuli rossi immaturi si riduce e vengono rapidamente eliminati dal flusso sanguigno.
L'aumento della degradazione dei globuli rossi (intravascolare e intracellulare) porta alla formazione di quantità eccessive di bilirubina, che non viene trasportata attraverso il fegato, si accumula nel plasma sanguigno e provoca lo sviluppo di ittero emolitico. Con la massiccia emolisi intravascolare dei globuli rossi, l'emoglobina non ha il tempo di essere assorbita dalle cellule del sistema mononucleare-fagocitico e viene escreta nelle urine, cioè si verifica emoglobinuria.
Cambiamenti patologici. Vengono registrati l'anemia e l'ittero della pelle non pigmentata, del tessuto sottocutaneo, delle mucose e dei tegumenti sierosi. Si notano iperplasia del midollo osseo rosso, ingrossamento e pletora della milza, del fegato e, meno spesso, dei reni, la presenza di vescia, urina giallo scuro o rosso-marrone. L'esame istologico rivela una pronunciata reazione dei macrofagi ed emosiderosi nel fegato e nella milza, cilindri di emoglobina nei tubuli renali, specialmente nell'anemia con intensa emolisi intravascolare dei globuli rossi, nonché iperplasia eritronormoblastica del midollo osseo.
Sintomi. A decorso acuto le anemie emolitiche distinguono due gruppi di sintomi. Il primo include sintomi generali associati allo sviluppo dell'ipossia e ai cambiamenti nel sistema circolatorio. Questi includono pallore delle mucose visibili e delle aree non pigmentate della pelle, tachicardia, mancanza di respiro, depressione, aumento della fatica, spesso aumento della temperatura corporea, diminuzione dell'appetito e indigestione.
Il secondo gruppo di segni è caratteristico dell'anemia emolitica - anemia e ingiallimento delle mucose visibili, e con massiccia emolisi dei globuli rossi - emoglobinuria.
Nel sangue degli animali malati il contenuto degli eritrociti diminuisce più bruscamente dell'emoglobina; compaiono in gran numero eritrociti con punteggiatura basofila, policromatofili, reticolociti ed eritronormociti (Fig. 45). Si notano anisocitosi e poichilocitosi, la resistenza degli eritrociti all'emolisi diminuisce e la VES aumenta. Il numero dei leucociti aumenta.
IN punteggiato del midollo osseo il numero di forme nucleari di leucociti aumenta di 1,5-2 volte. Il rapporto leucoeritroblastico indica una significativa predominanza dell'ematopoiesi eritroblastica. Allo stesso tempo, il contenuto di forme giovani e debolmente emoglobinizzate di cellule eritroidi aumenta notevolmente. A causa del ritardo nella maturazione di queste cellule, entrano nel sangue solo le forme immature di globuli rossi, che subiscono un'eliminazione accelerata. Questa eritropoiesi inefficace rallenta il recupero del sangue.
Negli animali malati aumenta il contenuto di bilirubina non convertita nel sangue, stercobilina nelle feci, urobilina e spesso emoglobina nelle urine. Con tali segni in grande bestiame si verificano emoglobinuria postpartum delle vacche ed emoglobinuria parossistica o abbeverata dei vitelli. L'emoglobinuria postpartum si osserva nelle vacche per i primi quattro mesi dopo il parto in aree con carenza di fosforo. L’emoglobinuria da consumo di acqua si verifica nei vitelli di età inferiore a un anno e di solito si verifica dopo aver bevuto molta acqua fredda. Con esso, a differenza di altre anemie emolitiche, la temperatura corporea si abbassa.
Le anemie emolitiche autoimmuni possono essere croniche. La condizione generale degli animali malati cambia gradualmente. Possono essere assenti dispnea e tachicardia, il che è associato ad un graduale adattamento all'ipossia. In tali animali viene rilevato un persistente ingrossamento della milza e del fegato. Nei punti del fegato e della milza viene rilevato un gran numero di macrofagi con emosiderina. In questi organi, soprattutto negli animali giovani, possono comparire focolai di emopoiesi extramidollare. Nel sangue si nota una persistente diminuzione del contenuto di eritrociti ed emoglobina e un leggero aumento del numero di leucociti, dovuto principalmente a linfociti ed eosinofili. La VES è notevolmente aumentata. L'iperplasia della linea eritroide predomina nel midollo osseo.
Il decorso dell'anemia emolitica autoimmune è caratterizzato da periodi di esacerbazione e attenuazione dei processi patologici.
Un importante segno diagnostico è la rilevazione di autoanticorpi fissi nel siero del sangue e sui globuli rossi.
Diagnosi e diagnosi differenziale. L'anemia emolitica viene diagnosticata sulla base dell'anamnesi (esposizione a veleni emolitici, possibili trasfusioni di sangue, trattamenti frequenti sangue allogenico, compatibilità delle coppie parentali, qualità del mangime, abbondanza di acqua, apporto di fosforo e vitamina E, ecc.), segni clinici caratteristici (anemia, ittero ed emoglobinuria) e risultati dei test di laboratorio (una forte diminuzione del livello di sangue rosso cellule del sangue ed emoglobina leggermente più debole, aumento del contenuto sierico di bilirubina indiretta, urobilina nelle urine e comparsa di emoglobina). Per diagnosticare l'anemia emolitica autoimmune, insieme ai segni indicati, vengono eseguite reazioni per rilevare autoanticorpi liberi e fissati sui globuli rossi. Gli anticorpi antieritrociti fissi vengono rilevati da quelli diretti e quelli liberi mediante test di Coombs indiretto.
Nella diagnosi differenziale è necessario distinguere tra anemia emolitica tossica, anemia emolitica autoimmune, emoglobinuria postpartum delle mucche, emoglobinuria parossistica (abbeverata) dei vitelli e malattia emolitica negli animali giovani appena nati, nonché escludere la piroplasmosi, la leptospirosi, Epatite virale, anemia infettiva dei cavalli.
Previsione dipende da diagnosi tempestiva e trattamento.
Trattamento. Mirato ad eliminare le cause, alleviare l'ipossia e l'intossicazione, stimolare l'eritropoiesi. All'inizio del trattamento, escludere tutte le cause sospette che possono causare emolisi dei globuli rossi. Se l'anemia è causata dall'azione dei veleni, il tratto gastrointestinale viene immediatamente lavato e vengono prescritti lassativi. In caso di intossicazione acuta è indicato il salasso, seguito dalla somministrazione di una soluzione isotonica, sangue, plasma e siero stabilizzati di un singolo gruppo, indipendentemente dal gruppo di appartenenza.
Nella dieta vengono introdotti alimenti ricchi di proteine, vitamine e ferro (per gli erbivori: verdure, buon fieno, concentrati; per gli onnivori -farina di carne e ossa, fegato, ecc.). Gli animali vengono posti in una stanza ventilata e sottoposti a esercizio quotidiano.
Per alleviare l'intossicazione, vengono somministrate per via endovenosa soluzioni ipertoniche di cloruro di sodio e calcio e una soluzione di glucosio con acido ascorbico. La terapia successiva dovrebbe mirare a stimolare l'eritropoiesi efficace, garantendo il flusso di globuli rossi ben emoglobinizzati nel sangue. A questo scopo vengono utilizzati preparati di ferro, cobalto, rame, acido ascorbico, vitamina B 12, emostimulina, fitina, ecc. Per l'emoglobinuria postpartum, alle mucche vengono inoltre prescritti preparati a base di fosforo: glicerofosfato di ferro, fosfene, fosfato biammonico, ecc.
Per il trattamento dell'anemia emolitica autoimmune è indicato l'uso di ormoni glucocorticoidi. Una condizione necessaria La terapia ormonale richiede un dosaggio e un utilizzo sufficienti. Il prednisolone viene spesso prescritto per via orale alla dose di 1 mg/kg di peso corporeo al giorno dosi equivalenti altri glucocorticoidi (cortisone, idrocortisone, prednisone).
Prevenzione. Evitare veleni emolitici, alcaloidi e saponine, morsi di serpente e trattamenti ripetuti di animali con sangue allogenico. Per l'accoppiamento dovrebbero essere selezionate coppie parentali compatibili; le vacche gravide e in parto dovrebbero ricevere una dieta completa, con un contenuto sufficiente di proteine e fosforo. Riescono a malapena a sopportare di nutrire grandi quantità di barbabietole da zucchero e dei loro prodotti, cavoli e colza. I vitelli sono protetti da abbondanti annaffiature con acqua fredda.
Anemia ipoplastica e aplastica (Anemia ipoplastica et aplastica) - gruppo di malattie che si manifestano compromissione funzionale tutti i germi dell'ematopoiesi e soprattutto dell'eritropoiesi. Sono caratterizzati da una moderata interruzione dei processi di proliferazione e differenziazione delle cellule ematopoietiche. Nell'anemia aplastica, a seguito dell'esaurimento dell'ematopoiesi del midollo osseo, si notano cambiamenti più profondi non solo nell'eritro-, ma anche nella leuco- e nella trombocitopoiesi. Pertanto, insieme all'anemia, si sviluppano leucopenia e trombocitopenia. Questi tipi di anemia si verificano in tutti i tipi di animali da allevamento.
Eziologia. L'anemia ipoplastica e iporigenerativa si sviluppa quando fallimento cronico nella dieta e nel corpo degli animali proteine, ferro, cobalto, rame, vitamine B 12, C, acido folico. Si presentano come complicanze della gastroenterite cronica e dell'epatite, in cui l'assorbimento e l'utilizzo delle sostanze nutritive biologicamente attive sono compromessi. Pertanto vengono spesso classificate come anemie da deficit nutrizionale (Fig. 46,47,48).
Forme gravi di anemia ipoplastica con transizione all'anemia aplastica si verificano con l'esposizione prolungata sostanze chimiche(piombo, mercurio, bismuto, arsenico, benzene, toluene), sostanze medicinali (sulfamidici, nitrofurani, antibiotici antitumorali, ecc.), micotossicosi croniche (fusariotossicosi, stachibotriotossicosi), disturbi metabolici (chetosi, ipovitaminosi dei gruppi B e C), decorso cronico di malattie infettive e invasive (paratubercolosi, tubercolosi, peste suina, anemia infettiva dei cavalli, leptospirosi, ascariasis, ecc.), leucemia, esposizione a radiazioni ionizzanti.
Lo sviluppo di questo tipo di anemia è facilitato dalla formazione insufficiente di eritropoietina nei reni, negli ormoni ipofisari (ACTH, STH) e nelle ghiandole surrenali (glucocorticoidi).
Patogenesi. A seconda dell'insufficienza dei fattori nutrizionali, della durata e dell'attività dell'esposizione ad altre cause, si sviluppa l'anemia ipoplastica o aplastica. In mancanza di fattori nutrizionali, la linea eritroide è prevalentemente inibita e con tossicosi cronica ed esposizione a radiazioni ionizzanti vengono inibite tre linee ematopoietiche: mieloide, eritroide e piastrinica.
Con una carenza cronica di fattori nutrizionali, la formazione delle cellule eritroidi viene interrotta e la maturazione viene ritardata. Fattori dannosi come radiazioni, micotossine, farmaci citostatici, virus e altri causano disturbi nell'apparato cromosomico delle cellule ematopoietiche, a seguito dei quali cambiano le loro proprietà antigeniche e si sviluppano processi autoimmuni.
Nel midollo osseo, con anemia ipo- e aplastica immunitaria, aumenta il numero di linfociti T, plasmacellule, macrofagi e compaiono anticorpi contro le cellule ematopoietiche. Tutto ciò porta all'inibizione e alla cessazione della proliferazione e della differenziazione delle cellule del midollo osseo. Se i meccanismi di sviluppo dell'anemia aplastica riguardano solo il germe eritroide, i cambiamenti si osservano solo nel sangue rosso. Con lo sviluppo di cambiamenti a livello delle cellule staminali, si verificano disturbi in tutta l'ematopoiesi. Il midollo osseo di animali così malati non fornisce la necessaria formazione di globuli rossi, leucociti e piastrine. I mielocariociti scompaiono dal midollo osseo e si sviluppa l'anemia aplastica. Nel sangue degli animali malati, insieme all'anemia, si osservano leucopenia e trombocitopenia.
Cambiamenti patologici. Caratterizzato da anemia ed emorragie sulle mucose, sulle membrane sierose e organi interni, degenerazione granulare e grassa del fegato, dei reni e del miocardio, atrofia del timo, dei linfonodi e della milza. Si osservano spesso infiammazioni del tratto respiratorio superiore, dei polmoni, del tratto gastrointestinale e ulcerazioni della mucosa orale.
I cambiamenti più caratteristici si riscontrano nel midollo osseo. Nell'anemia ipoplastica causata dalla mancanza di fattori nutrizionali, si sviluppa un'iperplasia reattiva, dovuta principalmente alle cellule eritroidi giovani. Nell'anemia ipoplastica e soprattutto aplastica, associata
Il sistema sanguigno comprende sangue periferico, organi emopoietici ed emopoietici (midollo osseo rosso, fegato, milza, linfonodi e altre formazioni linfoidi). IN periodo embrionale Gli organi emopoietici sono il fegato, la milza, il midollo osseo e il tessuto linfoide. Dopo la nascita di un bambino, l'ematopoiesi si concentra principalmente nel midollo osseo e si verifica nei bambini gioventù in tutte le ossa. A partire dal 1° anno di vita compaiono segni di trasformazione del midollo osseo rosso in giallo (grasso). Durante la pubertà si verifica l'emopoiesi ossa piatte(sterno, costole, corpi vertebrali), epifisi ossa tubolari, così come nei linfonodi e nella milza. Linfonodi. Gli organi più importanti della linfopoiesi. Nei neonati, rispetto agli adulti, sono più ricchi di vasi linfatici e di elementi linfoidi con molte forme giovanili, il cui numero diminuisce gradualmente dopo 4-5 anni di vita. L'immaturità morfologica e funzionale associata dei linfonodi porta alla loro insufficiente funzione barriera, e quindi nei bambini nei primi mesi di vita agenti infettivi penetrare facilmente nel flusso sanguigno. Non ci sono cambiamenti visibili nei linfonodi. All'età di 1-3 anni, i linfonodi iniziano a rispondere all'introduzione dell'agente patogeno. Dai 7-8 anni, grazie al completamento dello sviluppo dei linfonodi, diventa possibile la protezione locale contro gli agenti infettivi. La risposta all'infezione è un aumento delle dimensioni dei linfonodi e il loro dolore alla palpazione. Nei bambini sani vengono palpati i linfonodi cervicali (sottomandibolari, cervicali anteriori e posteriori, occipitali), ascellari e inguinali. Sono singoli, morbidi, mobili, non fusi tra loro o con il tessuto circostante, e hanno dimensioni variabili dal chicco di miglio a quello di lenticchia. Conoscendo la posizione dei linfonodi, è possibile determinare la direzione di diffusione dell'infezione e rilevare i loro cambiamenti durante processi patologici. Timo. Organo centrale dell'immunità. Quando il bambino nasce, è ben sviluppato. All'età di 1-3 anni, la sua massa aumenta. Con l'inizio della pubertà inizia l'involuzione legata all'età della ghiandola del timo. Milza. Uno di organi periferici immunità. Contiene la formazione di linfociti, la distruzione dei globuli rossi e delle piastrine, l'accumulo di ferro e la sintesi di immunoglobuline. Le funzioni della milza includono il deposito del sangue. Sistemi macrofagi (sistema reticoloendoteliale)è il sito di formazione dei monociti. Tonsille. Principali formazioni linfoidi. In un neonato si trovano in profondità e hanno piccole dimensioni. A causa della struttura e dell'immaturità funzionale delle tonsille, i bambini nel primo anno di vita raramente soffrono di tonsillite. Dai 5-10 anni si riscontra spesso un aumento tonsille palatine, spesso combinato con un aumento tonsilla nasofaringea e altre formazioni linfoidi della faringe. Iniziano dal periodo della pubertà sviluppo inverso. Il tessuto linfoide viene sostituito dal tessuto connettivo, le tonsille diminuiscono di dimensioni e diventano più dense. Per sistema emopoietico Il bambino è caratterizzato da pronunciata instabilità funzionale, lieve vulnerabilità, possibilità di ritorno in condizioni patologiche al tipo embrionale di emopoiesi o formazione di focolai extramidollari di emopoiesi. Allo stesso tempo, c'è la tendenza del sistema ematopoietico a subire processi di rigenerazione. Queste proprietà sono spiegate grande quantità cellule indifferenziate che irritazioni varie differenziati come nel periodo sviluppo embrionale. Sangue. Man mano che il bambino cresce, il sangue subisce peculiari cambiamenti nella sua composizione qualitativa e quantitativa. Secondo i parametri ematologici, tutto infanzia suddiviso in tre periodi: 1) neonati; 2) infanzia; 3) dopo 1 anno di vita.
Sangue di un neonato. Per il sangue periferico in questo periodo di età caratterizzato da un aumento del numero di globuli rossi e da un elevato livello di emoglobina. Il sangue contiene il 60-80% di emoglobina fetale. Nei neonati prematuri, il suo livello può essere dell'80-90%. Adattata al trasporto dell'ossigeno in condizioni di circolazione placentare, l'emoglobina fetale lega l'ossigeno più velocemente dell'emoglobina adulta, giocando ruolo importante durante il periodo di adattamento dei neonati alle nuove condizioni di vita. Gradualmente, durante i primi 3 mesi di vita, viene sostituita dall'emoglobina adulta. L'indice di colore durante il periodo neonatale supera 1 (fino a 1,3). Gli eritrociti di un neonato sono caratterizzati dalle seguenti differenze qualitative: anisocitosi (diversi colori degli eritrociti), aumento del contenuto di reticolociti (forme giovani di eritrociti contenenti granularità), presenza di normoblasti (forme giovani di eritrociti con presenza di un nucleo) . La velocità di eritrosedimentazione (VES) nei neonati è di 2-3 mm/h.
Nella formula dei leucociti nei primi giorni di vita di un bambino predominano i neutrofili (circa il 60-65%). Il numero di linfociti è del 16-34%; entro il 5-6o giorno di vita il numero di neutrofili e linfociti si equalizza (il primo crossover fisiologico nella formula dei leucociti). Entro la fine del primo mese di vita, il numero dei neutrofili diminuisce al 25-30% e i linfociti aumentano del 55-60% (Fig. 55). Sangue di un bambino di età superiore a 1 anno. Il numero dei globuli rossi e dell'emoglobina aumenta gradualmente; le forme giovani dei globuli rossi rimangono reticolociti, il cui numero varia dal 2 al 5%. L'indice di colore è 0,85-0,95, la VES è 4-10 mm/h. Il numero totale di leucociti diminuisce e anche il carattere cambia formula dei leucociti: il numero dei linfociti diminuisce gradualmente e i neutrofili aumentano e entro 5-6 anni il loro numero si equalizza, ad es. avviene il secondo incrocio della curva dei neutrofili (Fig. 55). Successivamente, l'aumento dei neutrofili e la diminuzione dei linfociti continuano e gradualmente la composizione del sangue si avvicina alla composizione del sangue degli adulti. SISTEMA DI COLLAGE DEL SANGUE i neonati e i bambini del 1° anno di vita hanno una serie di caratteristiche. Durante il periodo neonatale, la coagulazione viene rallentata, a causa di una diminuzione dell'attività dei componenti del complesso protrombinico: Fattori II, V e VII. Nei bambini del 1o anno di vita si osserva una formazione ritardata di tromboplastina. Nei primi giorni di vita l'attività dei fattori X e IV è ridotta. Durante il periodo neonatale si osserva anche una leggera diminuzione della quantità di fattore I. L'attività del sistema fibrinolitico nei bambini è spesso aumentata. Successivamente, con la maturazione del fegato, l'attività dei fattori della coagulazione diventa sufficiente e garantisce l'equilibrio del complesso sistema omeostatico.
 Piano 1. Sistema sanguigno 2. Emopoiesi nel periodo embrionale 3. Emopoiesi dopo la nascita 4. Linfonodi 5. Timo 6. Milza 7. Sistema reticoloendoteliale 8. Tonsille 9. Caratteristiche del sistema emopoietico del bambino 10. Sangue 11. Sistema di coagulazione del sangue 12. Domande di controllo
Piano 1. Sistema sanguigno 2. Emopoiesi nel periodo embrionale 3. Emopoiesi dopo la nascita 4. Linfonodi 5. Timo 6. Milza 7. Sistema reticoloendoteliale 8. Tonsille 9. Caratteristiche del sistema emopoietico del bambino 10. Sangue 11. Sistema di coagulazione del sangue 12. Domande di controllo
 Sistema sanguigno Il sistema sanguigno comprende: - sangue periferico; - organi dell'ematopoiesi e della distruzione del sangue (midollo osseo rosso, fegato, milza, linfonodi, formazioni linfoidi).
Sistema sanguigno Il sistema sanguigno comprende: - sangue periferico; - organi dell'ematopoiesi e della distruzione del sangue (midollo osseo rosso, fegato, milza, linfonodi, formazioni linfoidi).
 Emopoiesi nel periodo embrionale Durante il periodo embrionale della vita gli organi emopoietici sono: - fegato (dall'inizio del secondo mese); - milza (dal III-IV mese); - tessuto linfoide; - midollo osseo (inizia a funzionare solo dalla seconda metà del periodo embrionale).
Emopoiesi nel periodo embrionale Durante il periodo embrionale della vita gli organi emopoietici sono: - fegato (dall'inizio del secondo mese); - milza (dal III-IV mese); - tessuto linfoide; - midollo osseo (inizia a funzionare solo dalla seconda metà del periodo embrionale).
 Emopoiesi dopo la nascita Dopo la nascita, l'emopoiesi è concentrata principalmente nel midollo osseo e si verifica in tutte le ossa dei bambini piccoli. A partire dai 4 anni, in alcune ossa, il midollo osseo rosso comincia a degenerare in midollo grasso giallo e perde la sua funzione emopoietica. Nel periodo della pubertà, l'ematopoiesi rimane nel midollo osseo delle ossa piatte (sterno, costole, corpi vertebrali), nell'epifisi delle ossa tubolari e si verifica anche nei linfonodi e nella milza.
Emopoiesi dopo la nascita Dopo la nascita, l'emopoiesi è concentrata principalmente nel midollo osseo e si verifica in tutte le ossa dei bambini piccoli. A partire dai 4 anni, in alcune ossa, il midollo osseo rosso comincia a degenerare in midollo grasso giallo e perde la sua funzione emopoietica. Nel periodo della pubertà, l'ematopoiesi rimane nel midollo osseo delle ossa piatte (sterno, costole, corpi vertebrali), nell'epifisi delle ossa tubolari e si verifica anche nei linfonodi e nella milza.
 Linfonodi Gli organi più importanti della linfopoiesi. Ricco di vasi linfatici ed elementi linfoidi con numerose forme giovanili. I neonati sono morfologicamente e funzionalmente immaturi, il che porta alla loro insufficiente funzione di barriera. Dall'età di 7-8 anni, a causa del completamento del loro sviluppo, appare la possibilità di protezione locale contro gli agenti infettivi. Nei bambini sani si palpano le aree cervicale, ascellare e inguinale. Sono singoli, morbidi, non fusi tra loro o con il tessuto circostante, di dimensioni variabili dai chicchi di miglio alle lenticchie.
Linfonodi Gli organi più importanti della linfopoiesi. Ricco di vasi linfatici ed elementi linfoidi con numerose forme giovanili. I neonati sono morfologicamente e funzionalmente immaturi, il che porta alla loro insufficiente funzione di barriera. Dall'età di 7-8 anni, a causa del completamento del loro sviluppo, appare la possibilità di protezione locale contro gli agenti infettivi. Nei bambini sani si palpano le aree cervicale, ascellare e inguinale. Sono singoli, morbidi, non fusi tra loro o con il tessuto circostante, di dimensioni variabili dai chicchi di miglio alle lenticchie.
 La ghiandola del timo è l’organo centrale del sistema immunitario. Ben sviluppato al momento della nascita. Da 1 a 3 anni aumenta intensamente di dimensioni. Durante la pubertà inizia la sua involuzione.
La ghiandola del timo è l’organo centrale del sistema immunitario. Ben sviluppato al momento della nascita. Da 1 a 3 anni aumenta intensamente di dimensioni. Durante la pubertà inizia la sua involuzione.
 Organo della milza immunità periferica. In esso: - si formano i linfociti; - i globuli rossi e le piastrine vengono distrutti; - vengono sintetizzate le immunoglobuline; - il ferro si accumula. È un deposito di sangue.
Organo della milza immunità periferica. In esso: - si formano i linfociti; - i globuli rossi e le piastrine vengono distrutti; - vengono sintetizzate le immunoglobuline; - il ferro si accumula. È un deposito di sangue.

 Tonsille Le principali formazioni linfoidi. Nei neonati si trovano in profondità e di piccole dimensioni. A causa dell'immaturità strutturale e funzionale delle tonsille, i bambini nel primo anno di vita raramente soffrono di tonsillite. Da 5 a 10 anni si osserva spesso il loro aumento. Durante il periodo della pubertà inizia l'involuzione: il tessuto linfoide viene sostituito dal tessuto connettivo, le tonsille diminuiscono di dimensioni e diventano più dense.
Tonsille Le principali formazioni linfoidi. Nei neonati si trovano in profondità e di piccole dimensioni. A causa dell'immaturità strutturale e funzionale delle tonsille, i bambini nel primo anno di vita raramente soffrono di tonsillite. Da 5 a 10 anni si osserva spesso il loro aumento. Durante il periodo della pubertà inizia l'involuzione: il tessuto linfoide viene sostituito dal tessuto connettivo, le tonsille diminuiscono di dimensioni e diventano più dense.
 Caratteristiche del sistema ematopoietico del bambino: si esprimono instabilità funzionale e leggera vulnerabilità. Caratteristica è la possibilità di un ritorno in condizioni patologiche al tipo embrionale di emopoiesi o alla formazione di focolai extramidollari di emopoiesi. Esiste la tendenza del sistema emopoietico a subire processi di rigenerazione.
Caratteristiche del sistema ematopoietico del bambino: si esprimono instabilità funzionale e leggera vulnerabilità. Caratteristica è la possibilità di un ritorno in condizioni patologiche al tipo embrionale di emopoiesi o alla formazione di focolai extramidollari di emopoiesi. Esiste la tendenza del sistema emopoietico a subire processi di rigenerazione.
 Sangue Secondo gli indicatori ematologici, l'intera età dell'infanzia è divisa in 3 periodi: 1) neonati; 2) infanzia; 3) dopo 1 anno di vita.
Sangue Secondo gli indicatori ematologici, l'intera età dell'infanzia è divisa in 3 periodi: 1) neonati; 2) infanzia; 3) dopo 1 anno di vita.
 Sangue Principali indicatori ematici nei bambini di diverse età Indicatore Neonato Infante Bambino di età pari a 1 anno Emoglobina (g/l sangue) 166 -240 120 -115 126 -156 Globuli rossi 4, 5 -7, 5 3, 7 -4, 5 4, 3 -5 VES (mm/h) 2 - 3 3 -5 4 -10 Leucociti 10 -30 10 -11 6 -8 Neutrofili 60 -70 Granulociti, % 15 -40 Fino a 60 Linfociti, % 20 -30 55 -75 Fino a 35 Piastrine 200 -250 200 -300
Sangue Principali indicatori ematici nei bambini di diverse età Indicatore Neonato Infante Bambino di età pari a 1 anno Emoglobina (g/l sangue) 166 -240 120 -115 126 -156 Globuli rossi 4, 5 -7, 5 3, 7 -4, 5 4, 3 -5 VES (mm/h) 2 - 3 3 -5 4 -10 Leucociti 10 -30 10 -11 6 -8 Neutrofili 60 -70 Granulociti, % 15 -40 Fino a 60 Linfociti, % 20 -30 55 -75 Fino a 35 Piastrine 200 -250 200 -300
 Sangue Primo e secondo crossover della curva dei neutrofili e dei linfociti nei bambini Giorni % 1 2 3 4 5 6 7 8 9 10 11 12 70 60 50 40 Mesi Anni 1 2 3 4 5 6 7 8 9 10 1112 1 2 3 4 5 6 7 8 9 10 11 12 13 PRIMO CROCE SECONDO CROCE 30 20 Neutrofili ______ linfociti - - -
Sangue Primo e secondo crossover della curva dei neutrofili e dei linfociti nei bambini Giorni % 1 2 3 4 5 6 7 8 9 10 11 12 70 60 50 40 Mesi Anni 1 2 3 4 5 6 7 8 9 10 1112 1 2 3 4 5 6 7 8 9 10 11 12 13 PRIMO CROCE SECONDO CROCE 30 20 Neutrofili ______ linfociti - - -
 Sangue neonato Aumento del numero di globuli rossi e alto livello emoglobina. L'indice di colore è superiore a 1. La velocità di sedimentazione degli eritrociti è di 2 -3 mm/h. I neutrofili predominano nella formula dei leucociti.
Sangue neonato Aumento del numero di globuli rossi e alto livello emoglobina. L'indice di colore è superiore a 1. La velocità di sedimentazione degli eritrociti è di 2 -3 mm/h. I neutrofili predominano nella formula dei leucociti.
 Sangue di bambini 1 anno di vita Il numero di globuli rossi e di emoglobina diminuisce gradualmente. L'indice di colore è inferiore a 1. Anisocitosi e policromatofilia sono moderatamente espresse. La velocità di sedimentazione degli eritrociti varia da 3 a 5 mm/h. I linfociti predominano nella formula dei leucociti.
Sangue di bambini 1 anno di vita Il numero di globuli rossi e di emoglobina diminuisce gradualmente. L'indice di colore è inferiore a 1. Anisocitosi e policromatofilia sono moderatamente espresse. La velocità di sedimentazione degli eritrociti varia da 3 a 5 mm/h. I linfociti predominano nella formula dei leucociti.
 Sangue di un bambino di età superiore a 1 anno Il numero di globuli rossi e di emoglobina aumenta gradualmente. L'indice di colore è 0,85 -0,95 La velocità di sedimentazione eritrocitaria è 4 -10 mm/h;
Sangue di un bambino di età superiore a 1 anno Il numero di globuli rossi e di emoglobina aumenta gradualmente. L'indice di colore è 0,85 -0,95 La velocità di sedimentazione eritrocitaria è 4 -10 mm/h;
 Sistema di coagulazione del sangue Durante il periodo neonatale la coagulazione viene rallentata. Nei bambini del primo anno di vita, la formazione della tromboplastina è ritardata. L'attività del sistema fibrinolitico è spesso aumentata.
Sistema di coagulazione del sangue Durante il periodo neonatale la coagulazione viene rallentata. Nei bambini del primo anno di vita, la formazione della tromboplastina è ritardata. L'attività del sistema fibrinolitico è spesso aumentata.
 Domande di controllo 1. Raccontaci dell'emopoiesi del bambino prima e dopo la nascita. 2. Qual è l'organo centrale dell'ematopoiesi nei bambini e cosa sai di questo organo? 3. Quali cambiamenti nella formula dei leucociti si verificano durante l'infanzia?
Domande di controllo 1. Raccontaci dell'emopoiesi del bambino prima e dopo la nascita. 2. Qual è l'organo centrale dell'ematopoiesi nei bambini e cosa sai di questo organo? 3. Quali cambiamenti nella formula dei leucociti si verificano durante l'infanzia?
Metodi clinici per lo studio di pazienti con malattie del sistema sanguigno. Studio morfologico sangue periferico, valore diagnostico.
Sviluppo metodologico lezione pratica per gli studenti del terzo anno
Facoltà di Medicina
Corso - III semestre
Facoltà: medicinale
Durata della lezione: 4 ore accademiche
Posizione: Dipartimento di Cardiologia dell'Ospedale Clinico cittadino n. 4
1. Argomento delle lezioni: Metodi clinici per lo studio di pazienti con malattie del sistema sanguigno. Esame morfologico del sangue periferico, valore diagnostico.
2. L'importanza di studiare questo argomento. Lo studio di questo argomento fornisce una comprensione dei metodi di esame clinico dei pazienti con malattie del sistema sanguigno; gli organi ematopoietici sono estremamente sensibili a vari effetti fisiologici e patologici sul corpo, un riflesso del quale è l'immagine analisi periferica sangue normale e malato vari sistemi corpo.
3. Scopo della lezione: Insegna agli studenti esame clinico pazienti con malattie del sistema sanguigno e familiarizzare gli studenti con i principali indicatori dell'analisi clinica del sangue periferico in condizioni normali e nelle malattie di vari sistemi corporei.
Come risultato dello studio di questo argomento, lo studente dovrebbe sapere:
Le principali lamentele dei pazienti con malattie del sistema sanguigno;
Essere in grado di palpare i linfonodi periferici,
fegato, milza;
Indicatori analisi generale il sangue è normale;
Metodologia per determinare l'emoglobina, gli eritrociti, i leucociti, il contenuto di emoglobina in un eritrocita, la velocità di sedimentazione eritrocitaria (VES);
Metodo per il calcolo della formula dei leucociti;
Significato clinico globuli rossi, contenuto medio di emoglobina in un globulo rosso, VES;
Formula leucocitaria in patologia;
Introduzione alla puntura sternale, trepanobiopsia;
Comprendere il coagulogramma;
Autopreparazione per la lezione.
Come risultato dello studio autonomo, lo studente dovrebbe sapere:
Caratteristiche anatomiche e fisiologiche del sistema sanguigno;
Le principali lamentele dei pazienti con malattie del sistema sanguigno, il meccanismo della loro insorgenza;
Dati provenienti da un esame generale di pazienti con malattie del sistema sanguigno;
Essere in grado di palpare i linfonodi periferici, il fegato, la milza;
Essere in grado di analizzare i dati di un esame del sangue generale, analisi biochimiche sangue.
Sezioni base per ripetizioni ottenute dallo studente in discipline affini:
Caratteristiche anatomiche e fisiologiche del sistema sanguigno, schema dei germi emopoietici;
Metabolismo e scambio del ferro;
Sezioni di ripetizione ottenute in precedenza nella disciplina di propedeutica delle malattie internistiche:
La storia e le sue sezioni;
Esame generale;
Ispezione e palpazione dei linfonodi periferici;
Percussione e palpazione del fegato;
Palpazione della milza;
Auscultazione del cuore;
Studio delle proprietà dell'impulso;
Criteri per l'analisi del sangue periferico normale.
Domande per il ripasso e lo studio in preparazione alla lezione.
1. Caratteristiche anatomiche e fisiologiche del sistema sanguigno, schema dei germi emopoietici;
3. Le principali lamentele dei pazienti con malattie del sistema sanguigno, il meccanismo della loro insorgenza;
4. L'importanza dell'anamnesi per identificare i fattori che contribuiscono allo sviluppo dell'anemia.
5. L'importanza dell'esame fisico dei pazienti con il sistema sanguigno.
6. Il significato dei cambiamenti quantitativi e qualitativi composizione cellulare sangue:
a) eritrociti;
b) cambiamento nella forma e nel colore dei globuli rossi;
c) cambiamento dell'indicatore di colore;
d) numero di reticolociti;
e) leucocitosi e leucopenia;
e) spostamento neutrofilo;
g) eosinofilia e aneosinofilia;
h) linfocitosi e linfopenia;
i) monocitosi;
Domanda 1. Caratteristiche anatomiche e fisiologiche del sistema sanguigno.
Esistono diverse teorie sull'ematopoiesi, ma attualmente è generalmente accettata la teoria unitaria dell'ematopoiesi, sulla base della quale è stato sviluppato uno schema di emopoiesi (I. L. Chertkov e A. I. Vorobyov, 1973).
- teoria unitaria (A. A. Maksimov, 1909) - tutti gli elementi formati del sangue si sviluppano da un unico precursore di una cellula staminale;
- la teoria dualistica prevede due fonti di emopoiesi, quella mieloide e quella linfoide;
- La teoria polifiletica prevede per ogni elemento sagomato una propria fonte di sviluppo.
Nel processo di differenziazione graduale delle cellule staminali in cellule del sangue mature, in ciascuna fila dell'ematopoiesi si formano tipi intermedi di cellule, che costituiscono classi cellulari nello schema ematopoietico. In totale, nello schema ematopoietico si distinguono 6 classi di cellule:
1a classe - cellule staminali;
Classe 2 - cellule semi-staminali;
Classe 3: cellule unipotenti;
Classe 4: cellule esplosive;
Classe 5: cellule in maturazione;
Grado 6: elementi dalla forma matura.
Caratteristiche morfologiche e funzionali delle cellule di varie classi di emopoiesi.
1 classe- una cellula staminale pluripotente in grado di mantenere la propria popolazione. Nella morfologia corrisponde ad un piccolo linfocita, è pluripotente, capace cioè di differenziarsi in qualsiasi elemento formato del sangue. La direzione della differenziazione delle cellule staminali è determinata dal livello di questo elemento formato nel sangue, nonché dall'influenza del microambiente delle cellule staminali - l'influenza induttiva delle cellule stromali del midollo osseo o di altri organi ematopoietici. Il mantenimento della dimensione della popolazione di cellule staminali è assicurato dal fatto che dopo la mitosi della cellula staminale, una delle cellule figlie intraprende il percorso di differenziazione, e l'altra assume la morfologia di un piccolo linfocita ed è una cellula staminale. Le cellule staminali si dividono raramente (una volta ogni sei mesi), l'80% delle cellule staminali è in uno stato di riposo e solo il 20% è in mitosi e successiva differenziazione. Durante il processo di proliferazione, ciascuna cellula staminale forma un gruppo o clone di cellule, e pertanto le cellule staminali in letteratura sono spesso chiamate unità formanti clone - CFU.
2° grado- cellule semi-staminali, pluripotenti limitate (o parzialmente impegnate) - precursori della mielopoiesi e della linfopoiesi. Hanno la morfologia di un piccolo linfocita. Ciascuno di essi produce un clone di cellule, ma solo mieloidi o linfoidi. Si dividono più spesso (ogni 3-4 settimane) e mantengono anche le dimensioni della loro popolazione.
3a elementare- cellule unipotenti sensibili alla poetina - i predecessori della loro serie ematopoietica. La loro morfologia corrisponde anche a un piccolo linfocita. In grado di differenziarsi in una sola tipologia di elemento sagomato. Si dividono frequentemente, ma i discendenti di queste cellule alcuni intraprendono il percorso della differenziazione, mentre altri mantengono la dimensione della popolazione di questa classe. La frequenza di divisione di queste cellule e la capacità di differenziarsi ulteriormente dipende dal contenuto nel sangue di speciali sostanze biologicamente attive - poetine, specifiche per ciascuna serie di emopoiesi (eritropoietine, trombopoietine e altre).
Le prime tre classi di cellule sono combinate in una classe di cellule morfologicamente non identificabili, poiché hanno tutte la morfologia di un piccolo linfocita, ma le loro potenze di sviluppo sono diverse.
4 ° grado- cellule blastiche (giovani) o blasti (eritroblasti, linfoblasti, ecc.). Differiscono nella morfologia sia dalle tre classi di cellule precedenti che da quelle successive. Queste cellule sono grandi, hanno un grande nucleo sciolto (eucromatina) con 2-4 nucleoli, il citoplasma è basofilo a causa di un gran numero di ribosomi liberi. Si dividono frequentemente, ma le cellule figlie intraprendono tutte il percorso di un'ulteriore differenziazione. In base alle loro proprietà citochimiche si possono identificare blasti di diverse serie ematopoietiche.
5 ° grado- una classe di cellule in maturazione caratteristiche della loro serie ematopoietica. In questa classe possono esserci diverse varietà di cellule di transizione: da una (prolinfociti, promonociti) a cinque nella serie degli eritrociti. Alcune cellule in maturazione possono entrare nel sangue periferico in piccole quantità (ad esempio reticolociti, granulociti giovani e a banda).
6a elementare- cellule del sangue mature. Tuttavia, va notato che solo gli eritrociti, le piastrine e i granulociti segmentati sono cellule differenziate terminali mature o loro frammenti. I monociti non sono cellule completamente differenziate. In partenza flusso sanguigno, si differenziano in cellule finali: i macrofagi. Quando i linfociti incontrano gli antigeni, si trasformano in esplosioni e si dividono nuovamente.
L'insieme delle cellule che costituiscono la linea di differenziazione di una cellula staminale in un determinato elemento sagomato formano la sua serie differenziale o istologica. Ad esempio, il differenziale eritrocitario è:
- cellula staminale;
- precursore delle cellule semi-staminali della mielopoiesi;
- cellula unipotente sensibile all'eritropoietina;
- eritroblasto;
- cellule in maturazione: pronormociti, normociti basofili, normociti policromatofili, normociti ossifili, reticolociti, eritrociti.
Nel processo di maturazione degli eritrociti della classe 5, si verifica quanto segue: sintesi e accumulo di emoglobina, riduzione degli organelli, riduzione del nucleo. Normalmente, il rifornimento degli eritrociti viene effettuato principalmente attraverso la divisione e la differenziazione delle cellule in maturazione di pronormociti, normociti basofili e policromatofili. Questo tipo di emopoiesi è chiamata emopoiesi omoplastica. In caso di grave perdita di sangue, la ricostituzione dei globuli rossi è assicurata non solo dall'aumento della divisione delle cellule in maturazione, ma anche dalle cellule delle classi 4, 3, 2 e persino della classe 1, un tipo eteroplastico di emopoiesi che precede la rigenerazione riparativa di sangue Il sangue è un liquido (tessuto liquido di origine mesodermica), di colore rosso, debole reazione alcalina, sapore salato con un peso specifico di 1.054-1.066. Insieme al fluido tissutale e alla linfa, forma l'ambiente interno del corpo. Il sangue svolge molte funzioni. I più importanti sono i seguenti:
Trasporto nutrienti dal tratto digestivo ai tessuti, luoghi di riserva da essi (funzione trofica);
Trasporto dei prodotti finali del metabolismo dai tessuti agli organi escretori (funzione escretrice);
Trasporto di gas (ossigeno e anidride carbonica da organi respiratori ai tessuti e alla schiena; stoccaggio dell'ossigeno (funzione respiratoria);
Trasporto degli ormoni dalle ghiandole secrezione interna agli organi ( regolazione umorale);
Funzione protettiva - svolta a causa dell'attività fagocitaria dei leucociti ( immunità cellulare), la produzione di anticorpi da parte dei linfociti che neutralizzano le sostanze geneticamente estranee ( immunità umorale);
Coagulazione del sangue, prevenendo la perdita di sangue;
Funzione termoregolatrice - ridistribuzione del calore tra gli organi, regolazione del trasferimento di calore attraverso la pelle;
Funzione meccanica- impartire tensione di turgore agli organi a causa del flusso di sangue verso di essi; garantire l'ultrafiltrazione nei capillari delle capsule nefronali dei reni, ecc.;
Funzione omeostatica: mantenimento di un ambiente interno costante del corpo, adatto alle cellule in termini di composizione ionica, concentrazione di ioni idrogeno, ecc.
La relativa costanza della composizione e delle proprietà del sangue: l'omeostasi è una condizione necessaria e indispensabile per l'attività vitale di tutti i tessuti del corpo. Del volume totale del sangue, circa la metà circola in tutto il corpo. La restante metà viene trattenuta nei capillari dilatati di alcuni organi e viene detta depositata. Gli organi in cui viene depositato il sangue sono chiamati depositi di sangue.
Schema dell'ematopoiesi
(I.L. Chertkov e A.I. Vorobyov, 1973).
|
Milza. Contiene fino al 16% di tutto il sangue nelle sue lacune - processi dei capillari. Questo sangue è praticamente escluso dalla circolazione e non si mescola con il sangue circolante. Quando i muscoli lisci della milza si contraggono, le lacune vengono compresse e il sangue entra nel canale generale.
Fegato. Contiene fino al 20% del volume sanguigno. Il fegato funge da deposito del sangue grazie alla contrazione degli sfinteri delle vene epatiche, attraverso le quali scorre il sangue dal fegato. Quindi nel fegato entra più sangue di quanto ne esce. I capillari del fegato si dilatano, il flusso sanguigno al suo interno rallenta. Tuttavia, il sangue depositato nel fegato non è completamente escluso dal flusso sanguigno.
Tessuto sottocutaneo. Deposita fino al 10% del sangue. IN capillari sanguigni pelle ci sono anastomosi. Alcuni capillari si espandono, si riempiono di sangue e il flusso sanguigno avviene attraverso percorsi accorciati (shunt).
Polmoni possono anche essere classificati come organi che immagazzinano sangue. Anche il volume del letto vascolare dei polmoni non è costante; dipende dalla ventilazione degli alveoli, dalla pressione sanguigna al loro interno e dal riempimento sanguigno dei vasi grande cerchio circolazione sanguigna
Pertanto, il sangue depositato viene escluso dal flusso sanguigno e generalmente non si mescola con il sangue circolante. A causa dell'assorbimento dell'acqua, il sangue depositato è più denso, contiene un numero maggiore di elementi formati, il significato del sangue depositato è il seguente. Quando il corpo è in uno stato di riposo fisiologico, i suoi organi e tessuti non necessitano di un maggiore afflusso di sangue. In questo caso, la deposizione di sangue riduce il carico sul cuore e, di conseguenza, funziona a 1/5 - 1/6 della sua capacità. Se necessario, il sangue può passare rapidamente nel flusso sanguigno, ad esempio quando lavoro fisico, forti esperienze emotive, l'inalazione di aria ad alto contenuto di anidride carbonica - cioè, in tutti i casi in cui è necessario, aumenterà l'apporto di ossigeno e sostanze nutritive agli organi. Il sistema vegetativo è coinvolto nei meccanismi di ridistribuzione del sangue tra immagazzinato e circolante. sistema nervoso: nervi simpatici causare un aumento del volume del sangue circolante e parasimpatico - la transizione del sangue al deposito. Entrando nel sangue grande quantità l'adrenalina si verifica quando il sangue lascia il deposito. In caso di perdita di sangue, il volume del sangue viene ripristinato, prima di tutto, a causa del passaggio del fluido tissutale nel sangue, quindi il sangue depositato entra nel flusso sanguigno. Di conseguenza, il volume del plasma viene ripristinato molto più velocemente della quantità di elementi formati. Quando il volume del sangue aumenta (ad esempio, quando vengono somministrati molti sostituti del sangue o quando si beve una grande quantità di acqua), una parte del liquido viene rapidamente escreta dai reni, ma la maggior parte passa nei tessuti e viene poi gradualmente eliminato dall'organismo. Pertanto, il volume di sangue che riempie il letto vascolare viene ripristinato.
©2015-2019 sito
Tutti i diritti appartengono ai loro autori. Questo sito non ne rivendica la paternità, ma ne fornisce l'uso gratuito.
Data di creazione della pagina: 2016-02-16
- Sistema emopoietico Caratteristiche della struttura e della funzione dei linfonodi, del timo, della milza, delle tonsille
- Indicatori dell'emogramma Sistema di coagulazione del sangue
- Anemia: definizione, tipologie, Anemia da carenza di ferro
- Diatesi emorragica(vasculite emorragica, trombocitopenia, emofilia), leucemia: definizione, eziologia, patogenesi, quadro clinico, diagnostica di laboratorio, trattamento, cura, prevenzione Caratteristiche del lavoro di un'infermiera con pazienti affetti da leucemia
Caratteristiche anatomiche e fisiologiche del sistema sanguigno
Il sistema sanguigno comprende sangue periferico, organi emopoietici ed emopoietici (midollo osseo rosso, fegato, milza, linfonodi e altre formazioni linfoidi).
Durante il periodo embrionale della vita, gli organi emopoietici sono il fegato, la milza, il midollo osseo e il tessuto linfoide. Dopo la nascita di un bambino, l'ematopoiesi si concentra principalmente nel midollo osseo e si verifica in tutte le ossa dei bambini piccoli. A partire dal 1° anno di vita compaiono segni di trasformazione del midollo osseo rosso in giallo (grasso). Nel periodo della pubertà, l'ematopoiesi si verifica nelle ossa piatte (sterno, costole, corpi vertebrali), nelle epifisi delle ossa tubolari, nonché nei linfonodi e nella milza.
Linfonodi. Gli organi più importanti della linfopoiesi. Nei neonati, rispetto agli adulti, sono più ricchi di vasi linfatici e di elementi linfoidi con molte forme giovanili, il cui numero diminuisce gradualmente dopo 4-5 anni di vita. L'immaturità morfologica e funzionale associata dei linfonodi porta alla loro insufficiente funzione di barriera e quindi nei bambini nei primi mesi di vita gli agenti infettivi penetrano facilmente nel flusso sanguigno. Non ci sono cambiamenti visibili nei linfonodi. All'età di 1-3 anni, i linfonodi iniziano a rispondere all'introduzione dell'agente patogeno. Dai 7-8 anni, grazie al completamento dello sviluppo dei linfonodi, diventa possibile la protezione locale contro gli agenti infettivi. La risposta all'infezione è un aumento delle dimensioni dei linfonodi e il loro dolore alla palpazione. Nei bambini sani vengono palpati i linfonodi cervicali (sottomandibolari, cervicali anteriori e posteriori, occipitali), ascellari e inguinali. Sono singoli, morbidi, mobili, non fusi tra loro o con il tessuto circostante, e hanno dimensioni variabili dal chicco di miglio a quello di lenticchia. Conoscendo la posizione dei linfonodi, è possibile determinare la direzione di diffusione dell'infezione e rilevarne i cambiamenti durante i processi patologici.
Timo. Organo centrale dell'immunità. Quando il bambino nasce, è ben sviluppato. All'età di 1-3 anni, la sua massa aumenta. Con l'inizio della pubertà inizia l'involuzione legata all'età della ghiandola del timo.
Milza. Uno degli organi periferici del sistema immunitario. Contiene la formazione di linfociti, la distruzione dei globuli rossi e delle piastrine, l'accumulo di ferro e la sintesi di immunoglobuline. Le funzioni della milza includono il deposito del sangue.
Sistema dei macrofagi (sistema reticoloendoteliale)
è il sito di formazione dei monociti.
Tonsille. Principali formazioni linfoidi. Nel neonato si trovano in profondità e di piccole dimensioni. A causa della struttura e dell'immaturità funzionale delle tonsille, i bambini del 1° anno di vita raramente soffrono di tonsillite. Dai 5-10 anni di età si osserva spesso un ingrossamento delle tonsille palatine, spesso combinato con un ingrossamento delle tonsille nasofaringee e di altre formazioni linfoidi della faringe. Dal periodo della pubertà inizia il loro sviluppo inverso. Il tessuto linfoide viene sostituito dal tessuto connettivo, le tonsille diminuiscono di dimensioni e diventano più dense.
Il sistema emopoietico del bambino è caratterizzato da pronunciata instabilità funzionale, leggera vulnerabilità, possibilità di ritornare al tipo embrionale di emopoiesi in condizioni patologiche o formazione di focolai extramidollari di emopoiesi. Allo stesso tempo, c'è la tendenza del sistema ematopoietico a subire processi di rigenerazione. Queste proprietà sono spiegate da un gran numero di cellule indifferenziate che, sotto varie irritazioni, si differenziano allo stesso modo dello sviluppo embrionale.
Sangue. Man mano che il bambino cresce, il sangue subisce peculiari cambiamenti nella sua composizione qualitativa e quantitativa. Secondo gli indicatori ematologici, l'intera età infantile è divisa in tre periodi: 1) neonati; 2) infanzia; 3) dopo 1 anno di vita. I principali parametri del sangue periferico per tre gruppi di età sono riportati nella tabella. 9.
Sangue di un neonato. Il sangue periferico in questo periodo di età è caratterizzato da un aumento del numero di globuli rossi e da un alto livello di emoglobina. Il sangue contiene il 60-80% di emoglobina fetale. Nei neonati prematuri, il suo livello può essere dell'80-90%. Adattata al trasporto dell'ossigeno in condizioni di circolazione placentare, l'emoglobina fetale lega l'ossigeno più velocemente dell'emoglobina adulta, svolgendo un ruolo importante durante il periodo di adattamento dei neonati alle nuove condizioni di vita. Gradualmente, durante i primi 3 mesi di vita, viene sostituita dall'emoglobina adulta. L'indice di colore durante il periodo neonatale supera 1 (fino a 1,3). Gli eritrociti di un neonato sono caratterizzati dalle seguenti differenze qualitative: anisocitosi (diversa dimensione degli eritrociti), policromatofilia (diverso colore degli eritrociti), aumento del contenuto di reticolociti (forme giovani di eritrociti contenenti granularità), presenza di normoblasti (forme giovani di eritrociti con presenza di nucleo). La velocità di eritrosedimentazione (VES) nei neonati è di 2-3 mm/h.
Nella formula dei leucociti nei primi giorni di vita di un bambino predominano i neutrofili (circa il 60-65%). Il numero dei linfociti è del 16-34%, entro il 5-6° giorno di vita il numero dei neutrofili e dei linfociti si equalizza (il primo fisio-
Riso. 51.
croce logica nella formula dei leucociti). Entro la fine del primo mese di vita, il numero dei neutrofili diminuisce al 25-30% e quello dei linfociti aumenta al 55-60% (Fig. 51).
Sangue di bambini 1 anno di vita. Durante l’infanzia, il numero dei globuli rossi e i livelli di emoglobina diminuiscono gradualmente. Questo è spiegato maggiori requisiti in rapida crescita corpo del bambino e un ritardo nella sintesi dell'emoglobulina dai processi di formazione dei globuli rossi a causa di quantità insufficienti di proteine e ferro in questo periodo di età. L'indice di colore nei neonati è inferiore a 1. L'anisocitosi e la policromatofilia sono moderatamente espresse e si osservano nei primi due mesi di vita. I normoblasti sono singoli, il numero di reticolociti è in media del 5-6%, la VES varia da 3 a 5 mm/h. I linfociti predominano nella formula dei leucociti.
Sangue di un bambino di età superiore a 1 anno. Il numero dei globuli rossi e dell'emoglobina aumenta gradualmente; le forme giovani dei globuli rossi rimangono reticolociti, il cui numero varia dal 2 al 5%. L'indice di colore è 0,85-0,95, la VES è 4-10 mm/h. Il numero totale di leucociti diminuisce, cambia anche la natura della formula dei leucociti: il numero di linfociti diminuisce gradualmente e i neutrofili aumentano e entro 5-6 anni il loro numero si equalizza, cioè si verifica il secondo crossover della curva di neutrofili e linfociti (vedi Fig. 51). Successivamente continua l'aumento dei neutrofili e la diminuzione dei linfociti, gradualmente la composizione del sangue si avvicina alla composizione del sangue degli adulti.
Il sistema di coagulazione del sangue di neonati e bambini del 1o anno di vita ha una serie di caratteristiche. Durante il periodo neonatale, la coagulazione è lenta, a causa di una diminuzione dell'attività dei componenti del complesso protrombinico: fattori 11, V e VII. Nei bambini del 1o anno di vita si osserva una formazione ritardata di tromboplastina. Nei primi giorni di vita l'attività dei fattori X e IV è ridotta. Durante il periodo neonatale si osserva anche una leggera diminuzione della quantità di fattore I. L'attività del sistema fibrinolitico nei bambini è spesso aumentata. Successivamente, con la maturazione del fegato, l'attività dei fattori della coagulazione diventa sufficiente e garantisce l'equilibrio del complesso sistema omeostatico.